よむ、つかう、まなぶ。
資料5-3 先進医療Bの試験実施計画の変更について(告示番号48/ jRCTs031200375) (参考資料1) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35961.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第155回 11/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(第 151 回先進医療技術審査部会資料 再掲)
参考資料1
先進医療Bの試験実施計画の変更について
【申請医療機関】
国立がん研究センター中央病院
【先進医療告示番号と名称】
大臣告示番号 B48
シクロホスファミド静脈内投与療法
【適応症】
成人 T 細胞白血病(末梢血幹細胞の非血縁者間移植が行われたものに限る。)
【試験の概要】
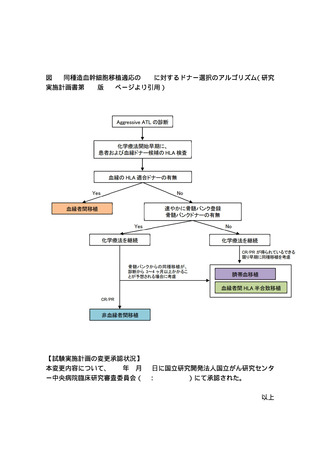
本試験は、成人 T 細胞白血病(adult T-cell leukemia/lymphoma:ATL)に対す
る移植後シクロホスファミド(post-transplant cyclophosphamide:PTCY)を用
いた非血縁者間末梢血幹細胞移植の有効性および安全性を検討するための第 II
相試験である。主要評価項目は、移植後 100 日までの無 grade III-IV 急性移
植片対宿主病(graft-versus-host disease:GVHD)生存割合である。
GVHD 予防を目的として、ヒト白血球抗原(human leukocyte antigen:HLA)適
合または 1〜2 アリル不適合の非血縁ドナーから提供された末梢血幹細胞の輸
注後 3 日目および 4 日目にシクロホスファミド 50mg/kg/day を投与する。ま
た、輸注後 5 日目からタクロリムスおよびミコフェノール酸モフェチルの投与
を開始する。
【実施期間】
予定登録期間:2 年間(2021 年 3 月 1 日〜2023 年 2 月 28 日)
追 跡 期 間:移植後 1 年間
解 析 期 間:1 年間
研 究 実 施 期 間 :4 年間(2021 年 3 月 1 日〜2025 年 2 月 28 日)
【予定症例数】
24 症例
参考資料1
先進医療Bの試験実施計画の変更について
【申請医療機関】
国立がん研究センター中央病院
【先進医療告示番号と名称】
大臣告示番号 B48
シクロホスファミド静脈内投与療法
【適応症】
成人 T 細胞白血病(末梢血幹細胞の非血縁者間移植が行われたものに限る。)
【試験の概要】
本試験は、成人 T 細胞白血病(adult T-cell leukemia/lymphoma:ATL)に対す
る移植後シクロホスファミド(post-transplant cyclophosphamide:PTCY)を用
いた非血縁者間末梢血幹細胞移植の有効性および安全性を検討するための第 II
相試験である。主要評価項目は、移植後 100 日までの無 grade III-IV 急性移
植片対宿主病(graft-versus-host disease:GVHD)生存割合である。
GVHD 予防を目的として、ヒト白血球抗原(human leukocyte antigen:HLA)適
合または 1〜2 アリル不適合の非血縁ドナーから提供された末梢血幹細胞の輸
注後 3 日目および 4 日目にシクロホスファミド 50mg/kg/day を投与する。ま
た、輸注後 5 日目からタクロリムスおよびミコフェノール酸モフェチルの投与
を開始する。
【実施期間】
予定登録期間:2 年間(2021 年 3 月 1 日〜2023 年 2 月 28 日)
追 跡 期 間:移植後 1 年間
解 析 期 間:1 年間
研 究 実 施 期 間 :4 年間(2021 年 3 月 1 日〜2025 年 2 月 28 日)
【予定症例数】
24 症例