よむ、つかう、まなぶ。
患-5○患者申出療養の終了に伴う取下げについて (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00029.html |
| 出典情報 | 患者申出療養評価会議(第47回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
患
-
5
5 . 1 2 . 21
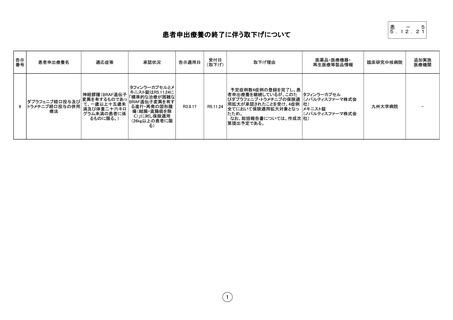
患者申出療養の終了に伴う取下げについて
告示
番号
9
患者申出療養名
適応症等
承認状況
タフィンラーカプセルとメ
キニスト錠はR5.11.24に
神経膠腫(BRAF遺伝子
「標準的な治療が困難な
変異を有するものであっ
ダブラフェニブ経口投与及び
BRAF遺伝子変異を有す
て、一歳以上十五歳未
トラメチニブ経口投与の併用
る進行・再発の固形腫
満及び体重二十六キロ
療法
瘍(結腸・直腸癌を除
グラム未満の患者に係
く)」に対し保険適用
るものに限る。)
(26kg以上の患者に限
る)
告示適用日
R3.9.17
受付日
(取下げ)
取下げ理由
医薬品・医療機器・
再生医療等製品情報
予定症例数4症例の登録を完了し、患
者申出療養を継続しているが、このた タフィンラーカプセル
びダブラフェニブ・トラメチニブの保険適 (ノバルティスファーマ株式会
用拡大が承認されたことを受け、4症例 社)
R5.11.24
全てにおいて保険適用拡大対象となっ メキニスト錠
たため。
(ノバルティスファーマ株式会
なお、総括報告書については、作成次 社)
第提出予定である。
1
臨床研究中核病院
追加実施
医療機関
九州大学病院
-
5
5 . 1 2 . 21
患者申出療養の終了に伴う取下げについて
告示
番号
9
患者申出療養名
適応症等
承認状況
タフィンラーカプセルとメ
キニスト錠はR5.11.24に
神経膠腫(BRAF遺伝子
「標準的な治療が困難な
変異を有するものであっ
ダブラフェニブ経口投与及び
BRAF遺伝子変異を有す
て、一歳以上十五歳未
トラメチニブ経口投与の併用
る進行・再発の固形腫
満及び体重二十六キロ
療法
瘍(結腸・直腸癌を除
グラム未満の患者に係
く)」に対し保険適用
るものに限る。)
(26kg以上の患者に限
る)
告示適用日
R3.9.17
受付日
(取下げ)
取下げ理由
医薬品・医療機器・
再生医療等製品情報
予定症例数4症例の登録を完了し、患
者申出療養を継続しているが、このた タフィンラーカプセル
びダブラフェニブ・トラメチニブの保険適 (ノバルティスファーマ株式会
用拡大が承認されたことを受け、4症例 社)
R5.11.24
全てにおいて保険適用拡大対象となっ メキニスト錠
たため。
(ノバルティスファーマ株式会
なお、総括報告書については、作成次 社)
第提出予定である。
1
臨床研究中核病院
追加実施
医療機関
九州大学病院