よむ、つかう、まなぶ。
資料2-2 開発要請を行った要望に係る検討状況等について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
No.
要望番号
成分名
要請内容
要望者
会社名
未承認薬
適応外薬
の分類
小児WG
開発要請に対する企業見解
注
(概略)
検討状況等
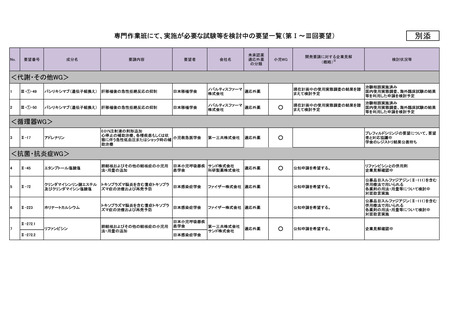
<精神・神経WG>
9
Ⅳ-157
レベチラセタム
てんかん重積
日本小児神経学
会、日本てんかん
学会、日本てんか
ん協会
10
ⅣS-8
ベバシズマブ(遺伝子組換え)
放射線脳壊死に起因する脳浮腫
日本脳神経外科学
会日本放射線腫瘍
中外製薬株式会社
学会日本定位放射
線治療学会
ユーシービージャパ
適応外薬
ン株式会社
迅速実用化
○
公知申請を希望する。
企業見解確認中
公知申請を希望する。
画像診断に用いる製剤の開発状況を踏ま
えて検討中
<抗菌・抗炎症WG>
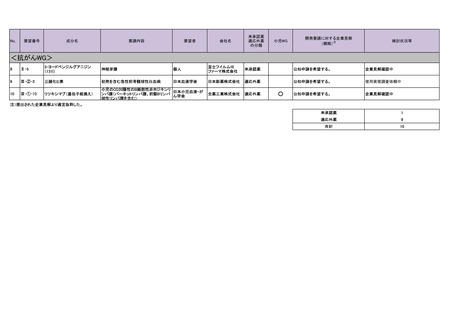
<抗がんWG>
11
Ⅳ-25
カペシタビン
神経内分泌腫瘍
日本神経内分泌腫
チェプラファーマ株式
瘍研究会
会社
適応外薬
日本膵臓学会
中外製薬株式会社
パンキャンジャパン
公知申請を希望する。
要望者にて追加調査の実施を検討中
12
Ⅳ-26
テモゾロミド
神経内分泌腫瘍
日本神経内分泌腫
瘍研究会
MSD株式会社
日本膵臓学会
パンキャンジャパン
適応外薬
公知申請を希望する。
要望者にて追加調査の実施を検討中
13
Ⅳ-39
チオテパ
中枢神経系リンパ腫(原発性およびその 日本リンパ網内系
他のリンパ腫の中枢神経系浸潤を含む) 学会
適応外薬
公知申請を希望する。
企業見解確認中
公知申請を希望する。
当該医薬品は「新有効成分含有医薬品」
に該当し、承認申請において日本人にお
ける当該医薬品の有効性及び安全性をよ
り慎重に評価する必要があり、その際に
日本人を対象とした臨床試験成績は必要
である。
詳細な試験計画については、これまでに
得られた情報を整理し、実施可能性も考
慮した上で機構と治験相談等を実施する
ことを推奨する。
なお、開発方針について、以下の点に留
意すること。
要望書の内容、海外診療ガイドライン等
を踏まえると、少なくとも①再発例におけ
るロムスチン単独投与及び②切除術等施
行後の患者を対象としたロムスチンと他剤
との併用投与の2つについて開発すること
が望ましいこと。
英国の承認内容のうち、120 mg/m2の
設定根拠となる臨床試験成績が、企業見
解からは確認できないことから、当該用
法・用量の適切性については英国での承
認の経緯も含めて確認・検討する必要が
あること。
14
Ⅳ-62
ロムスチン(CCNU)
神経膠腫
日本脳腫瘍学会
大日本住友製薬株
式会社
medac Pharma
未承認薬
要望番号
成分名
要請内容
要望者
会社名
未承認薬
適応外薬
の分類
小児WG
開発要請に対する企業見解
注
(概略)
検討状況等
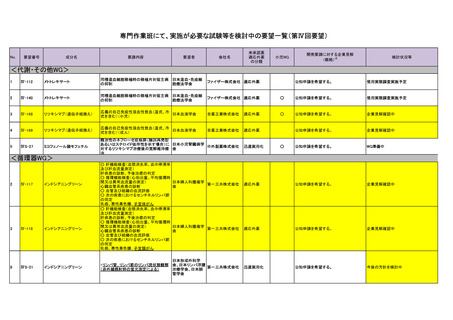
<精神・神経WG>
9
Ⅳ-157
レベチラセタム
てんかん重積
日本小児神経学
会、日本てんかん
学会、日本てんか
ん協会
10
ⅣS-8
ベバシズマブ(遺伝子組換え)
放射線脳壊死に起因する脳浮腫
日本脳神経外科学
会日本放射線腫瘍
中外製薬株式会社
学会日本定位放射
線治療学会
ユーシービージャパ
適応外薬
ン株式会社
迅速実用化
○
公知申請を希望する。
企業見解確認中
公知申請を希望する。
画像診断に用いる製剤の開発状況を踏ま
えて検討中
<抗菌・抗炎症WG>
<抗がんWG>
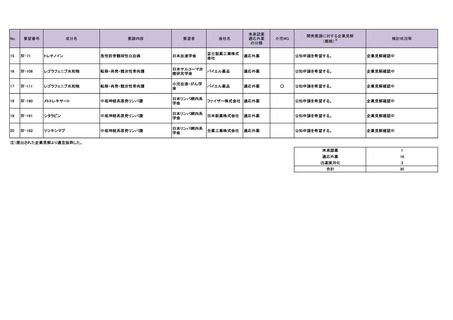
11
Ⅳ-25
カペシタビン
神経内分泌腫瘍
日本神経内分泌腫
チェプラファーマ株式
瘍研究会
会社
適応外薬
日本膵臓学会
中外製薬株式会社
パンキャンジャパン
公知申請を希望する。
要望者にて追加調査の実施を検討中
12
Ⅳ-26
テモゾロミド
神経内分泌腫瘍
日本神経内分泌腫
瘍研究会
MSD株式会社
日本膵臓学会
パンキャンジャパン
適応外薬
公知申請を希望する。
要望者にて追加調査の実施を検討中
13
Ⅳ-39
チオテパ
中枢神経系リンパ腫(原発性およびその 日本リンパ網内系
他のリンパ腫の中枢神経系浸潤を含む) 学会
適応外薬
公知申請を希望する。
企業見解確認中
公知申請を希望する。
当該医薬品は「新有効成分含有医薬品」
に該当し、承認申請において日本人にお
ける当該医薬品の有効性及び安全性をよ
り慎重に評価する必要があり、その際に
日本人を対象とした臨床試験成績は必要
である。
詳細な試験計画については、これまでに
得られた情報を整理し、実施可能性も考
慮した上で機構と治験相談等を実施する
ことを推奨する。
なお、開発方針について、以下の点に留
意すること。
要望書の内容、海外診療ガイドライン等
を踏まえると、少なくとも①再発例におけ
るロムスチン単独投与及び②切除術等施
行後の患者を対象としたロムスチンと他剤
との併用投与の2つについて開発すること
が望ましいこと。
英国の承認内容のうち、120 mg/m2の
設定根拠となる臨床試験成績が、企業見
解からは確認できないことから、当該用
法・用量の適切性については英国での承
認の経緯も含めて確認・検討する必要が
あること。
14
Ⅳ-62
ロムスチン(CCNU)
神経膠腫
日本脳腫瘍学会
大日本住友製薬株
式会社
medac Pharma
未承認薬