よむ、つかう、まなぶ。
○その他 総-5参考 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00262.html |
| 出典情報 | 中央社会保険医療協議会 総会(第 591 回 7/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
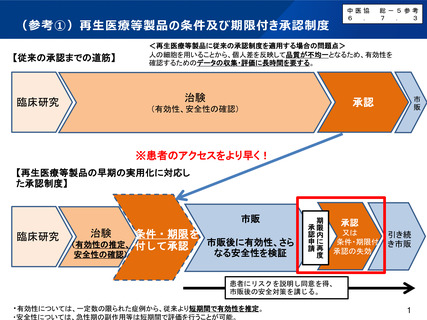
(参考②)条件及び期限付き承認を受けた再生医療等製品一覧
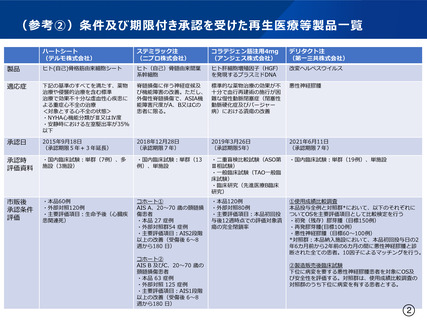
ハートシート
(テルモ株式会社)
ステミラック注
(ニプロ株式会社)
コラテジェン筋注用4mg
(アンジェス株式会社)
デリタクト注
(第一三共株式会社)
製品
ヒト(自己)骨格筋由来細胞シート
ヒト(自己)骨髄由来間葉
系幹細胞
ヒト肝細胞増殖因子(HGF)
を発現するプラスミドDNA
改変ヘルペスウイルス
適応症
下記の基準のすべてを満たす、薬物
治療や侵襲的治療を含む標準
治療で効果不十分な虚血性心疾患に
よる重症心不全の治療
<対象とする心不全の状態>
・NYHA心機能分類がⅢ又はⅣ度
・安静時における左室駆出率が35%
以下
脊髄損傷に伴う神経症候及
び機能障害の改善。ただし、
外傷性脊髄損傷で、ASIA機
能障害尺度がA、B又はCの
患者に限る。
標準的な薬物治療の効果が不
十分で血行再建術の施行が困
難な慢性動脈閉塞症(閉塞性
動脈硬化症及びバージャー
病)における潰瘍の改善
悪性神経膠腫
承認日
2015年9月18日
(承認期限5年+3年延長)
2018年12月28日
(承認期限7年)
2019年3月26日
(承認期限5年)
2021年6月11日
(承認期限7年)
承認時
評価資料
・国内臨床試験:単群(7例)、多
施設(3施設)
・国内臨床試験:単群(13
例)、単施設
・二重盲検比較試験(ASO第
Ⅲ相試験)
・一般臨床試験(TAO一般臨
床試験)
・臨床研究(先進医療B臨床
研究)
・国内臨床試験:単群(19例)、単施設
市販後
承認条件
評価
・本品60例
・外部対照120例
・主要評価項目:生命予後(心臓疾
患関連死)
コホート①
AIS A、20~70 歳の頚髄損
傷患者
・本品 27 症例
・外部対照群54 症例
・主要評価項目:AIS2段階
以上の改善(受傷後 6~8
週から180 日)
・本品120例
・外部対照80例
・主要評価項目:本品初回投
与後12週時点での評価対象潰
瘍の完全閉鎖率
①使用成績比較調査
本品投与全例と対照群*において、以下のそれぞれに
ついてOSを主要評価項目として比較検定を行う
・初発(残存)膠芽腫(目標150例)
・再発膠芽腫(目標100例)
・悪性神経膠腫(目標60~100例)
*対照群:本品納入施設において、本品初回投与日の2
年6カ月前から2年前の6カ月の間に悪性神経膠腫と診
断された全ての患者。10因子によるマッチングを行う。
コホート②
AIS B 及びC、20~70 歳の
頚髄損傷患者
・本品 63 症例
・外部対照 125 症例
・主要評価項目:AIS1段階
以上の改善(受傷後 6~8
週から180 日)
②製造販売後臨床試験
下位に病変を要する悪性神経膠腫患者を対象にOS及
び安全性を評価する。対照群は、使用成績比較調査の
対照群のうち下位に病変を有する患者とする。
2
ハートシート
(テルモ株式会社)
ステミラック注
(ニプロ株式会社)
コラテジェン筋注用4mg
(アンジェス株式会社)
デリタクト注
(第一三共株式会社)
製品
ヒト(自己)骨格筋由来細胞シート
ヒト(自己)骨髄由来間葉
系幹細胞
ヒト肝細胞増殖因子(HGF)
を発現するプラスミドDNA
改変ヘルペスウイルス
適応症
下記の基準のすべてを満たす、薬物
治療や侵襲的治療を含む標準
治療で効果不十分な虚血性心疾患に
よる重症心不全の治療
<対象とする心不全の状態>
・NYHA心機能分類がⅢ又はⅣ度
・安静時における左室駆出率が35%
以下
脊髄損傷に伴う神経症候及
び機能障害の改善。ただし、
外傷性脊髄損傷で、ASIA機
能障害尺度がA、B又はCの
患者に限る。
標準的な薬物治療の効果が不
十分で血行再建術の施行が困
難な慢性動脈閉塞症(閉塞性
動脈硬化症及びバージャー
病)における潰瘍の改善
悪性神経膠腫
承認日
2015年9月18日
(承認期限5年+3年延長)
2018年12月28日
(承認期限7年)
2019年3月26日
(承認期限5年)
2021年6月11日
(承認期限7年)
承認時
評価資料
・国内臨床試験:単群(7例)、多
施設(3施設)
・国内臨床試験:単群(13
例)、単施設
・二重盲検比較試験(ASO第
Ⅲ相試験)
・一般臨床試験(TAO一般臨
床試験)
・臨床研究(先進医療B臨床
研究)
・国内臨床試験:単群(19例)、単施設
市販後
承認条件
評価
・本品60例
・外部対照120例
・主要評価項目:生命予後(心臓疾
患関連死)
コホート①
AIS A、20~70 歳の頚髄損
傷患者
・本品 27 症例
・外部対照群54 症例
・主要評価項目:AIS2段階
以上の改善(受傷後 6~8
週から180 日)
・本品120例
・外部対照80例
・主要評価項目:本品初回投
与後12週時点での評価対象潰
瘍の完全閉鎖率
①使用成績比較調査
本品投与全例と対照群*において、以下のそれぞれに
ついてOSを主要評価項目として比較検定を行う
・初発(残存)膠芽腫(目標150例)
・再発膠芽腫(目標100例)
・悪性神経膠腫(目標60~100例)
*対照群:本品納入施設において、本品初回投与日の2
年6カ月前から2年前の6カ月の間に悪性神経膠腫と診
断された全ての患者。10因子によるマッチングを行う。
コホート②
AIS B 及びC、20~70 歳の
頚髄損傷患者
・本品 63 症例
・外部対照 125 症例
・主要評価項目:AIS1段階
以上の改善(受傷後 6~8
週から180 日)
②製造販売後臨床試験
下位に病変を要する悪性神経膠腫患者を対象にOS及
び安全性を評価する。対照群は、使用成績比較調査の
対照群のうち下位に病変を有する患者とする。
2