よむ、つかう、まなぶ。
【参考4】医薬品の安定確保を図るための取組(現状と今後の取組) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24780.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第6回 3/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考資料4
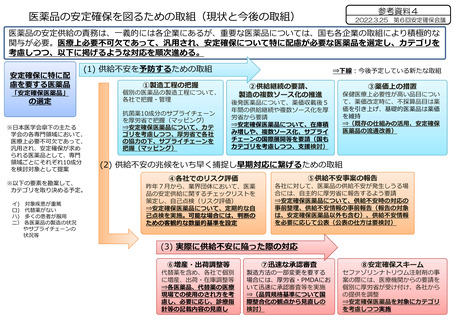
医薬品の安定確保を図るための取組(現状と今後の取組)
2022.3.25 第6回安定確保会議
医薬品の安定供給の責務は、一義的には各企業にあるが、重要な医薬品については、国も各企業の取組により積極的な
関与が必要。医療上必要不可欠であって、汎用され、安定確保について特に配慮が必要な医薬品を選定し、カテゴリを
考慮しつつ、以下に掲げるような対応を順次進める。
安定確保に特に配
慮を要する医薬品
(1) 供給不安を予防するための取組
「安定確保医薬品」
の選定
※日本医学会傘下の主たる
学会の各専門領域において、
医療上必要不可欠であって、
汎用され、安定確保が求め
られる医薬品として、専門
領域ごとにそれぞれ10成分
を検討対象として提案
※以下の要素を勘案して、
カテゴリを取り決める予定。
イ)
ロ)
ハ)
ニ)
対象疾患が重篤
代替薬がない
多くの患者が服用
各医薬品の製造の状況
やサプライチェーンの
状況等
⇒下線:今後予定している新たな取組
①製造工程の把握
個別の医薬品の製造工程について、
各社で把握・管理
抗菌薬10成分のサプライチェーン
を厚労省で把握(マッピング)
⇒安定確保医薬品について、カテ
ゴリを考慮しつつ、厚労省で各社
の協力の下、サプライチェーンを
把握(マッピング)
②供給継続の要請、
製造の複数ソース化の推進
後発医薬品について、薬価収載後5
年間の供給継続や複数ソース化を厚
労省から要請
⇒安定確保医薬品について、在庫積
み増しや、複数ソース化、サプライ
チェーンの国際展開等を要請(国も
カテゴリを考慮しつつ、支援検討)
③薬価上の措置
保健医療上必要性が高い品目につい
て、薬価改定時に、不採算品目は薬
価を引き上げ、基礎的医薬品は薬価
を維持
⇒(既存の仕組みの活用、安定確保
医薬品の流通改善)
(2) 供給不安の兆候をいち早く捕捉し早期対応に繋げるための取組
④各社でのリスク評価
昨年7月から、業界団体において、医薬
品の安定供給に関するチェックリストを
策定し、自己点検(リスク評価)
⇒安定確保医薬品について、定期的な自
己点検を実施。可能な場合には、判断の
ための客観的な数量的基準を設定
⑤供給不安事案の報告
各社に対して、医薬品の供給不安が発生しうる場
合には、自主的に厚労省に報告するよう要請
⇒安定確保医薬品について、供給不安時の対応の
事前整理、供給不安情報の事前報告(報告の対象
は、安定確保医薬品以外も含む)、供給不安情報
を必要に応じて公表(公表の仕方は要検討)
(3) 実際に供給不安に陥った際の対応
⑥増産・出荷調整等
代替薬を含め、各社で個別
に増産、出荷・在庫調整等
⇒各医薬品、代替薬の医療
現場での使用のされ方を考
慮し、必要に応じ、診療指
針等の記載内容の見直し
⑦迅速な承認審査
製造方法の一部変更を要する
場合には、厚労省・PMDAにお
いて迅速に承認審査等を実施
⇒(品質規格基準について国
際整合化の観点から見直しの
検討)
⑧安定確保スキーム
セファゾリンナトリウム注射剤の事
案の際には、医療機関からの要請を
個別に厚労省が受け付け、各社から
の提供を調整
⇒安定確保医薬品を対象にカテゴリ
を考慮しつつ実施
医薬品の安定確保を図るための取組(現状と今後の取組)
2022.3.25 第6回安定確保会議
医薬品の安定供給の責務は、一義的には各企業にあるが、重要な医薬品については、国も各企業の取組により積極的な
関与が必要。医療上必要不可欠であって、汎用され、安定確保について特に配慮が必要な医薬品を選定し、カテゴリを
考慮しつつ、以下に掲げるような対応を順次進める。
安定確保に特に配
慮を要する医薬品
(1) 供給不安を予防するための取組
「安定確保医薬品」
の選定
※日本医学会傘下の主たる
学会の各専門領域において、
医療上必要不可欠であって、
汎用され、安定確保が求め
られる医薬品として、専門
領域ごとにそれぞれ10成分
を検討対象として提案
※以下の要素を勘案して、
カテゴリを取り決める予定。
イ)
ロ)
ハ)
ニ)
対象疾患が重篤
代替薬がない
多くの患者が服用
各医薬品の製造の状況
やサプライチェーンの
状況等
⇒下線:今後予定している新たな取組
①製造工程の把握
個別の医薬品の製造工程について、
各社で把握・管理
抗菌薬10成分のサプライチェーン
を厚労省で把握(マッピング)
⇒安定確保医薬品について、カテ
ゴリを考慮しつつ、厚労省で各社
の協力の下、サプライチェーンを
把握(マッピング)
②供給継続の要請、
製造の複数ソース化の推進
後発医薬品について、薬価収載後5
年間の供給継続や複数ソース化を厚
労省から要請
⇒安定確保医薬品について、在庫積
み増しや、複数ソース化、サプライ
チェーンの国際展開等を要請(国も
カテゴリを考慮しつつ、支援検討)
③薬価上の措置
保健医療上必要性が高い品目につい
て、薬価改定時に、不採算品目は薬
価を引き上げ、基礎的医薬品は薬価
を維持
⇒(既存の仕組みの活用、安定確保
医薬品の流通改善)
(2) 供給不安の兆候をいち早く捕捉し早期対応に繋げるための取組
④各社でのリスク評価
昨年7月から、業界団体において、医薬
品の安定供給に関するチェックリストを
策定し、自己点検(リスク評価)
⇒安定確保医薬品について、定期的な自
己点検を実施。可能な場合には、判断の
ための客観的な数量的基準を設定
⑤供給不安事案の報告
各社に対して、医薬品の供給不安が発生しうる場
合には、自主的に厚労省に報告するよう要請
⇒安定確保医薬品について、供給不安時の対応の
事前整理、供給不安情報の事前報告(報告の対象
は、安定確保医薬品以外も含む)、供給不安情報
を必要に応じて公表(公表の仕方は要検討)
(3) 実際に供給不安に陥った際の対応
⑥増産・出荷調整等
代替薬を含め、各社で個別
に増産、出荷・在庫調整等
⇒各医薬品、代替薬の医療
現場での使用のされ方を考
慮し、必要に応じ、診療指
針等の記載内容の見直し
⑦迅速な承認審査
製造方法の一部変更を要する
場合には、厚労省・PMDAにお
いて迅速に承認審査等を実施
⇒(品質規格基準について国
際整合化の観点から見直しの
検討)
⑧安定確保スキーム
セファゾリンナトリウム注射剤の事
案の際には、医療機関からの要請を
個別に厚労省が受け付け、各社から
の提供を調整
⇒安定確保医薬品を対象にカテゴリ
を考慮しつつ実施