よむ、つかう、まなぶ。
資料1 検討会議における検討の進め方 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
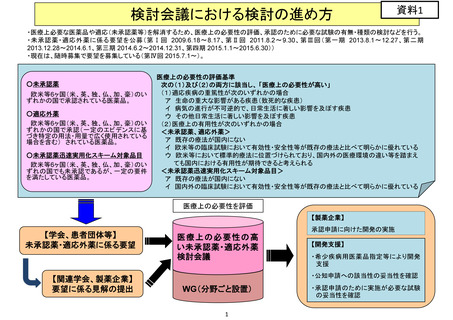
検討会議における検討の進め方
検討会議
各企業
(個別具体的検討については、専門作業班(WG)で実施)
開発の検討の開始
学会・
患者会等
医療上の必要性
の評価
個別ヒアリング
国が企業へ開発要請
基準に該当
開発企業を募集
国内開発企業
がない場合
必要に応じて、機構に相談
・開発工程表の作成
・必要な試験又は公知申請
への該当性に係る、エビデ
ンスに基づく見解の作成
要請から1ヵ月後
見解の提出
必要な試験の妥当性又は
公知申請への該当性の評価
随時照会等
必要な試験の実施検討又
は公知申請の準備(申請
書、添付文書案作成等)等
公知に該当
審議会の
事前評価
欧米等6ヵ国での
承認等
+
一定の要件を満
たす欧米未承認
の重篤・致死的疾
患治療薬
募集に応じた企業を支援するため、
必要な試験の妥当性又は公知申請
への該当性の評価
定期的に開発状況を確認
治験の着手
承認申請・
一変申請
中医協 薬価専門部会
において開発状況の報告
公知申請
2
中医協
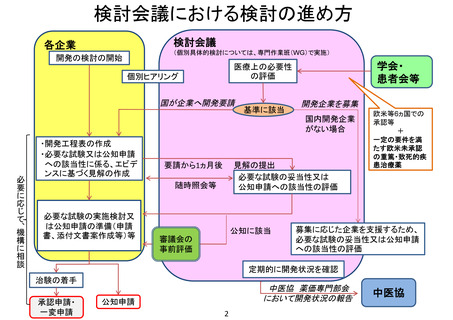
検討会議
各企業
(個別具体的検討については、専門作業班(WG)で実施)
開発の検討の開始
学会・
患者会等
医療上の必要性
の評価
個別ヒアリング
国が企業へ開発要請
基準に該当
開発企業を募集
国内開発企業
がない場合
必要に応じて、機構に相談
・開発工程表の作成
・必要な試験又は公知申請
への該当性に係る、エビデ
ンスに基づく見解の作成
要請から1ヵ月後
見解の提出
必要な試験の妥当性又は
公知申請への該当性の評価
随時照会等
必要な試験の実施検討又
は公知申請の準備(申請
書、添付文書案作成等)等
公知に該当
審議会の
事前評価
欧米等6ヵ国での
承認等
+
一定の要件を満
たす欧米未承認
の重篤・致死的疾
患治療薬
募集に応じた企業を支援するため、
必要な試験の妥当性又は公知申請
への該当性の評価
定期的に開発状況を確認
治験の着手
承認申請・
一変申請
中医協 薬価専門部会
において開発状況の報告
公知申請
2
中医協