よむ、つかう、まなぶ。
資料7 未承認薬検討会議の更なる運用の円滑化について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
資料 7
未承認薬検討会議の更なる運用の円滑化について
主な課題
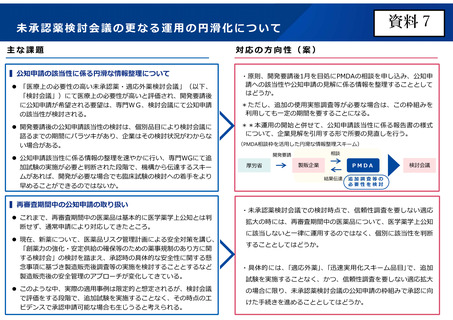
▍公知申請の該当性に係る円滑な情報整理について
「医療上の必要性の高い未承認薬・適応外薬検討会議」(以下、
「検討会議」)にて医療上の必要性が高いと評価され、開発要請後
に公知申請が希望される要望は、専門WG、検討会議にて公知申請
の該当性が検討される。
開発要請後の公知申請該当性の検討は、個別品目により検討会議に
諮るまでの期間にバラツキがあり、企業はその検討状況がわからな
い場合がある。
公知申請該当性に係る情報の整理を速やかに行い、専門WGにて追
加試験の実施が必要と判断された段階で、機構から伝達するスキー
ムがあれば、開発が必要な場合でも臨床試験の検討への着手をより
早めることができるのではないか。
▍再審査期間中の公知申請の取り扱い
これまで、再審査期間中の医薬品は基本的に医学薬学上公知とは判
断せず、通常申請により対応してきたところ。
現在、新薬について、医薬品リスク管理計画による安全対策を講じ、
「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関
する検討会」の検討を踏まえ、承認時の具体的な安全性に関する懸
念事項に基づき製造販売後調査等の実施を検討することとするなど
製造販売後の安全管理のアプローチが変化してきている。
このような中、実際の適用事例は限定的と想定されるが、検討会議
で評価をする段階で、追加試験を実施することなく、その時点のエ
ビデンスで承認申請可能な場合も生じうると考えられる。
対応の方向性(案)
・原則、開発要請後1月を目処にPMDAの相談を申し込み、公知申
請への該当性や公知申請の見解に係る情報を整理することとして
はどうか。
*ただし、追加の使用実態調査等が必要な場合は、この枠組みを
利用しても一定の期間を要することになる。
**本運用の開始と併せて、公知申請該当性に係る報告書の様式
について、企業見解を引用する形で所要の見直しを行う。
(PMDA相談枠を活用した円滑な情報整理スキーム)
相談
開発要請
厚労省
製販企業
PMDA
結果伝達
検討会議
追加調査等の
必要性を検討
・未承認薬検討会議での検討時点で、信頼性調査を要しない適応
拡大の時には、再審査期間中の医薬品について、医学薬学上公知
に該当しないと一律に運用するのではなく、個別に該当性を判断
することとしてはどうか。
・具体的には、「適応外薬」、「迅速実用化スキーム品目」で、追加
試験を実施することなく、かつ、信頼性調査を要しない適応拡大
の場合に限り、未承認薬検討会議の公知申請の枠組みで承認に向
けた手続きを進めることとしてはどうか。
未承認薬検討会議の更なる運用の円滑化について
主な課題
▍公知申請の該当性に係る円滑な情報整理について
「医療上の必要性の高い未承認薬・適応外薬検討会議」(以下、
「検討会議」)にて医療上の必要性が高いと評価され、開発要請後
に公知申請が希望される要望は、専門WG、検討会議にて公知申請
の該当性が検討される。
開発要請後の公知申請該当性の検討は、個別品目により検討会議に
諮るまでの期間にバラツキがあり、企業はその検討状況がわからな
い場合がある。
公知申請該当性に係る情報の整理を速やかに行い、専門WGにて追
加試験の実施が必要と判断された段階で、機構から伝達するスキー
ムがあれば、開発が必要な場合でも臨床試験の検討への着手をより
早めることができるのではないか。
▍再審査期間中の公知申請の取り扱い
これまで、再審査期間中の医薬品は基本的に医学薬学上公知とは判
断せず、通常申請により対応してきたところ。
現在、新薬について、医薬品リスク管理計画による安全対策を講じ、
「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関
する検討会」の検討を踏まえ、承認時の具体的な安全性に関する懸
念事項に基づき製造販売後調査等の実施を検討することとするなど
製造販売後の安全管理のアプローチが変化してきている。
このような中、実際の適用事例は限定的と想定されるが、検討会議
で評価をする段階で、追加試験を実施することなく、その時点のエ
ビデンスで承認申請可能な場合も生じうると考えられる。
対応の方向性(案)
・原則、開発要請後1月を目処にPMDAの相談を申し込み、公知申
請への該当性や公知申請の見解に係る情報を整理することとして
はどうか。
*ただし、追加の使用実態調査等が必要な場合は、この枠組みを
利用しても一定の期間を要することになる。
**本運用の開始と併せて、公知申請該当性に係る報告書の様式
について、企業見解を引用する形で所要の見直しを行う。
(PMDA相談枠を活用した円滑な情報整理スキーム)
相談
開発要請
厚労省
製販企業
PMDA
結果伝達
検討会議
追加調査等の
必要性を検討
・未承認薬検討会議での検討時点で、信頼性調査を要しない適応
拡大の時には、再審査期間中の医薬品について、医学薬学上公知
に該当しないと一律に運用するのではなく、個別に該当性を判断
することとしてはどうか。
・具体的には、「適応外薬」、「迅速実用化スキーム品目」で、追加
試験を実施することなく、かつ、信頼性調査を要しない適応拡大
の場合に限り、未承認薬検討会議の公知申請の枠組みで承認に向
けた手続きを進めることとしてはどうか。