よむ、つかう、まなぶ。
資料1-1 製造販売後調査の終了に伴うリスク区分の検討について[524KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
なお、医薬品のうち安全上特に問題がないものについては、平成 11 年及
エ
び 16 年に医薬部外品に移行されており、参考として第4類とする。
○ 上記の考え方に沿って、以下のような手順で分類を作成した。(別紙2)
・
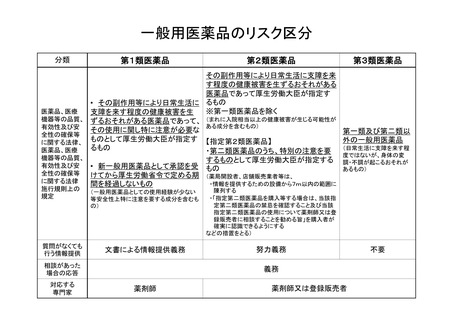
一般用医薬品に配合される主たる成分について、各成分のリスクの評価をもと
に、
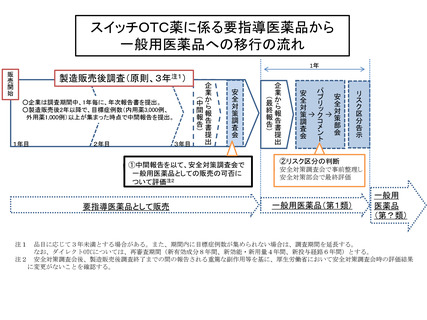
「スイッチOTCの市販後調査(PMS)期間中又は PMS 終了後引き続き副
作用等の発現に注意を要するもの」に相当する成分を第1類に、「相互作用」、
「副作用」及び「患者背景」のいずれかの項目でリスクの高い成分を第2類に、
それ以外を第3類に機械的に振り分ける。
・
機械的な振り分けの結果の妥当性について、専門的な知識・経験をもとに個々
の成分毎にさらに検討を加え評価する。
※
なお、第2類については、分類内においてもリスクの種類や程度が比
較的広いとの指摘があったことから、陳列方法を工夫する等の対応が望ま
しい成分を選択した。(別紙2のうち*を付されたもの)
※
上記の分類との整合性を考慮しつつ、漢方製剤、生薬、消毒薬、殺虫
薬及び一般用検査薬についても、その分類を検討し、追加した。(別紙3)
○ この結果、一般用医薬品について製品群として 85 製品群、成分としてのべ 485 成
分(漢方製剤、生薬、消毒薬、殺虫薬及び一般用検査薬を除く)についてリスク評
価を行ったこととなる。
○ 以上の分類は、現在時点で承認されている医薬品の添付文書を基にした分類である
ことに留意する必要がある。この成分の分類は変更があり得るものであり、その時
点その時点における新たな知見、使用に係る情報の集積により不断の見直しが行わ
れることが必要である。
○ なお、医薬部外品は誤った使い方をしない限り、特段のリスクはなく、医薬品とし
ての販売規制を行う必要性はない。しかし、平成 11 年及び 16 年に医薬部外品に移
行された品目のように、他の医薬部外品(パーマネント・ウエーブ用剤、薬用化粧
品類など)と比べ、軽度ではあるが何らかの症状の緩和のために使用される、用法
用量を守り過剰摂取に注意が必要である等、医薬品に近い性質を持っている品目も
ある。このため、医薬品とは引き続き区別しつつ、これを医薬部外品とは分けて整
理するといった検討をすべきである。
5
エ
び 16 年に医薬部外品に移行されており、参考として第4類とする。
○ 上記の考え方に沿って、以下のような手順で分類を作成した。(別紙2)
・
一般用医薬品に配合される主たる成分について、各成分のリスクの評価をもと
に、
「スイッチOTCの市販後調査(PMS)期間中又は PMS 終了後引き続き副
作用等の発現に注意を要するもの」に相当する成分を第1類に、「相互作用」、
「副作用」及び「患者背景」のいずれかの項目でリスクの高い成分を第2類に、
それ以外を第3類に機械的に振り分ける。
・
機械的な振り分けの結果の妥当性について、専門的な知識・経験をもとに個々
の成分毎にさらに検討を加え評価する。
※
なお、第2類については、分類内においてもリスクの種類や程度が比
較的広いとの指摘があったことから、陳列方法を工夫する等の対応が望ま
しい成分を選択した。(別紙2のうち*を付されたもの)
※
上記の分類との整合性を考慮しつつ、漢方製剤、生薬、消毒薬、殺虫
薬及び一般用検査薬についても、その分類を検討し、追加した。(別紙3)
○ この結果、一般用医薬品について製品群として 85 製品群、成分としてのべ 485 成
分(漢方製剤、生薬、消毒薬、殺虫薬及び一般用検査薬を除く)についてリスク評
価を行ったこととなる。
○ 以上の分類は、現在時点で承認されている医薬品の添付文書を基にした分類である
ことに留意する必要がある。この成分の分類は変更があり得るものであり、その時
点その時点における新たな知見、使用に係る情報の集積により不断の見直しが行わ
れることが必要である。
○ なお、医薬部外品は誤った使い方をしない限り、特段のリスクはなく、医薬品とし
ての販売規制を行う必要性はない。しかし、平成 11 年及び 16 年に医薬部外品に移
行された品目のように、他の医薬部外品(パーマネント・ウエーブ用剤、薬用化粧
品類など)と比べ、軽度ではあるが何らかの症状の緩和のために使用される、用法
用量を守り過剰摂取に注意が必要である等、医薬品に近い性質を持っている品目も
ある。このため、医薬品とは引き続き区別しつつ、これを医薬部外品とは分けて整
理するといった検討をすべきである。
5