よむ、つかう、まなぶ。
議題1 参考資料1-1患者申出療養の総括報告書に関する評価について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49601.html |
| 出典情報 | 患者申出療養評価会議(第57回 1/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
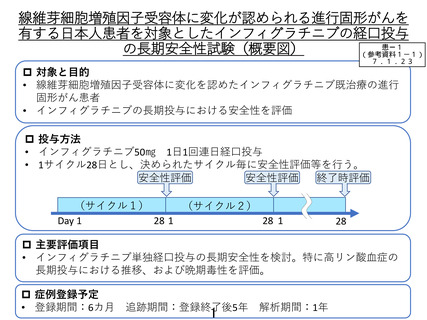
線維芽細胞増殖因子受容体に変化が認められる進行固形がんを
有する日本人患者を対象としたインフィグラチニブの経口投与
患ー1
の長期安全性試験(概要図)
(参考資料1-1)
7.1.23
対象と目的
• 線維芽細胞増殖因子受容体に変化を認めたインフィグラチニブ既治療の進行
固形がん患者
• インフィグラチニブの長期投与における安全性を評価
投与方法
• インフィグラチニブ50㎎ 1日1回連日経口投与
• 1サイクル28日とし、決められたサイクル毎に安全性評価等を行う。
安全性評価
安全性評価
終了時評価
(サイクル1)
(サイクル2)
Day 1
28 1
28 1
28
主要評価項目
• インフィグラチニブ単独経口投与の長期安全性を検討。特に高リン酸血症の
長期投与における推移、および晩期毒性を評価。
症例登録予定
• 登録期間:6カ月
追跡期間:登録終了後5年
1
解析期間:1年
有する日本人患者を対象としたインフィグラチニブの経口投与
患ー1
の長期安全性試験(概要図)
(参考資料1-1)
7.1.23
対象と目的
• 線維芽細胞増殖因子受容体に変化を認めたインフィグラチニブ既治療の進行
固形がん患者
• インフィグラチニブの長期投与における安全性を評価
投与方法
• インフィグラチニブ50㎎ 1日1回連日経口投与
• 1サイクル28日とし、決められたサイクル毎に安全性評価等を行う。
安全性評価
安全性評価
終了時評価
(サイクル1)
(サイクル2)
Day 1
28 1
28 1
28
主要評価項目
• インフィグラチニブ単独経口投与の長期安全性を検討。特に高リン酸血症の
長期投与における推移、および晩期毒性を評価。
症例登録予定
• 登録期間:6カ月
追跡期間:登録終了後5年
1
解析期間:1年