よむ、つかう、まなぶ。
資料2-20 沈降 20 価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体)の副反 応疑い報告状況について[206KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00138.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第106回 4/14)医薬品等安全対策部会安全対策調査会(令和7年度第1回 4/14)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第106回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和7年度
第1回薬事審議会医薬品等安全対策部会安全対策調査会
資料2-20
2025(令和7)年4月14日
沈降20価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体)の
副反応疑い報告状況について
○沈降20価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体)
商
品
名 : プレベナー20水性懸濁注
製 造 販 売 業 者 : ファイザー株式会社
販 売 開 始 : 令和6年8月
○高齢者又は肺炎球菌による疾患に罹患するリスクが高いと考えられる者における肺炎球菌(血清型1、3、
4、5、6A、6B、7F、8、9V、10A、11A、12F、14、15B、18C、19A、19F、22F、23F及び33F)による感染症の予防
効 能 ・ 効 果 :
○肺炎球菌(血清型1、3、4、5、6A、6B、7F、8、9V、10A、11A、12F、14、15B、18C、19A、19F、22F、23F及び
33F)
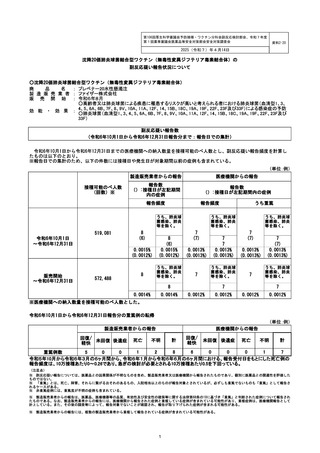
副反応疑い報告数
(令和6年10月1日から令和6年12月31日報告分まで:報告日での集計)
令和6年10月1日から令和6年12月31日までの医療機関への納入数量を接種可能のべ人数とし、副反応疑い報告頻度を計算し
たものは以下のとおり。
※報告日での集計のため、以下の件数には接種日や発生日が対象期間以前の症例も含まれている。
(単位:例)
接種可能のべ人数
(回数)※
製造販売業者からの報告
医療機関からの報告
報告数
():接種日が左記期間
内の症例
報告数
():接種日が左記期間内の症例
報告頻度
報告頻度
うち、肺炎球
菌感染、肺炎
等を除く。
519,081
令和6年10月1日
~令和6年12月31日
販売開始
~令和6年12月31日
572,488
8
(6)
0.0015%
(0.0012%)
8
(6)
0.0015%
(0.0012%)
8
うち、肺炎球
菌感染、肺炎
等を除く。
うち、肺炎球
菌感染、肺炎
等を除く。
7
(7)
0.0013%
(0.0013%)
7
7
0.0013%
(0.0013%)
7
うち、肺炎球
菌感染、肺炎
等を除く。
8
0.0014%
うち重篤
うち、肺炎球
菌感染、肺炎
等を除く。
7
(7)
0.0013%
(0.0013%)
7
(7)
0.0013%
(0.0013%)
7
うち、肺炎球
菌感染、肺炎
等を除く。
7
0.0014%
0.0012%
0.0012%
7
0.0012%
0.0012%
※医療機関への納入数量を接種可能のべ人数とした。
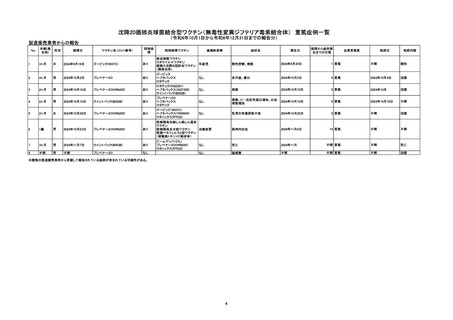
令和6年10月1日から令和6年12月31日報告分の重篤例の転帰
(単位:例)
製造販売業者からの報告
回復/
未回復 後遺症
軽快
死亡
医療機関からの報告
不明
計
回復/
軽快
未回復 後遺症
死亡
不明
計
1
2
8
6
0
0
0
1
7
重篤例数
5
0
0
令和5年10月から令和6年3月の6ヶ月間から、令和6年1月から令和6年6月の6ヶ月間における、報告受付日をもとにした死亡例の
報告頻度は、10万接種あたり0~0.26であり、急ぎの検討が必要とされる10万接種あたり0.5を下回っている。
(注意点)
※ 副反応疑い報告については、医薬品との因果関係が不明なものを含め、製造販売業者又は医療機関から報告されたものであり、個別に医薬品との関連性を評価した
ものではない。
※ 「重篤」とは、死亡、障害、それらに繋がるおそれのあるもの、入院相当以上のものが報告対象とされているが、必ずしも重篤でないものも「重篤」として報告さ
れるケースがある。
※ 非重篤症例には、重篤度が不明の症例も含まれている。
※ 製造販売業者からの報告は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の10に基づき「重篤」と判断された症例について報告され
たものである。なお、製造販売業者からの報告には、医療機関から報告された症例と重複している症例が含まれている可能性があり、重複症例は、医療機関報告として
計上している。また、その後の調査等によって、報告対象でないことが確認され、報告が取り下げられた症例が含まれる可能性がある。
※
製造販売業者からの報告には、複数の製造販売業者から重複して報告されている症例が含まれている可能性がある。
1
第1回薬事審議会医薬品等安全対策部会安全対策調査会
資料2-20
2025(令和7)年4月14日
沈降20価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体)の
副反応疑い報告状況について
○沈降20価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体)
商
品
名 : プレベナー20水性懸濁注
製 造 販 売 業 者 : ファイザー株式会社
販 売 開 始 : 令和6年8月
○高齢者又は肺炎球菌による疾患に罹患するリスクが高いと考えられる者における肺炎球菌(血清型1、3、
4、5、6A、6B、7F、8、9V、10A、11A、12F、14、15B、18C、19A、19F、22F、23F及び33F)による感染症の予防
効 能 ・ 効 果 :
○肺炎球菌(血清型1、3、4、5、6A、6B、7F、8、9V、10A、11A、12F、14、15B、18C、19A、19F、22F、23F及び
33F)
副反応疑い報告数
(令和6年10月1日から令和6年12月31日報告分まで:報告日での集計)
令和6年10月1日から令和6年12月31日までの医療機関への納入数量を接種可能のべ人数とし、副反応疑い報告頻度を計算し
たものは以下のとおり。
※報告日での集計のため、以下の件数には接種日や発生日が対象期間以前の症例も含まれている。
(単位:例)
接種可能のべ人数
(回数)※
製造販売業者からの報告
医療機関からの報告
報告数
():接種日が左記期間
内の症例
報告数
():接種日が左記期間内の症例
報告頻度
報告頻度
うち、肺炎球
菌感染、肺炎
等を除く。
519,081
令和6年10月1日
~令和6年12月31日
販売開始
~令和6年12月31日
572,488
8
(6)
0.0015%
(0.0012%)
8
(6)
0.0015%
(0.0012%)
8
うち、肺炎球
菌感染、肺炎
等を除く。
うち、肺炎球
菌感染、肺炎
等を除く。
7
(7)
0.0013%
(0.0013%)
7
7
0.0013%
(0.0013%)
7
うち、肺炎球
菌感染、肺炎
等を除く。
8
0.0014%
うち重篤
うち、肺炎球
菌感染、肺炎
等を除く。
7
(7)
0.0013%
(0.0013%)
7
(7)
0.0013%
(0.0013%)
7
うち、肺炎球
菌感染、肺炎
等を除く。
7
0.0014%
0.0012%
0.0012%
7
0.0012%
0.0012%
※医療機関への納入数量を接種可能のべ人数とした。
令和6年10月1日から令和6年12月31日報告分の重篤例の転帰
(単位:例)
製造販売業者からの報告
回復/
未回復 後遺症
軽快
死亡
医療機関からの報告
不明
計
回復/
軽快
未回復 後遺症
死亡
不明
計
1
2
8
6
0
0
0
1
7
重篤例数
5
0
0
令和5年10月から令和6年3月の6ヶ月間から、令和6年1月から令和6年6月の6ヶ月間における、報告受付日をもとにした死亡例の
報告頻度は、10万接種あたり0~0.26であり、急ぎの検討が必要とされる10万接種あたり0.5を下回っている。
(注意点)
※ 副反応疑い報告については、医薬品との因果関係が不明なものを含め、製造販売業者又は医療機関から報告されたものであり、個別に医薬品との関連性を評価した
ものではない。
※ 「重篤」とは、死亡、障害、それらに繋がるおそれのあるもの、入院相当以上のものが報告対象とされているが、必ずしも重篤でないものも「重篤」として報告さ
れるケースがある。
※ 非重篤症例には、重篤度が不明の症例も含まれている。
※ 製造販売業者からの報告は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の10に基づき「重篤」と判断された症例について報告され
たものである。なお、製造販売業者からの報告には、医療機関から報告された症例と重複している症例が含まれている可能性があり、重複症例は、医療機関報告として
計上している。また、その後の調査等によって、報告対象でないことが確認され、報告が取り下げられた症例が含まれる可能性がある。
※
製造販売業者からの報告には、複数の製造販売業者から重複して報告されている症例が含まれている可能性がある。
1