よむ、つかう、まなぶ。
資料3 HPVワクチンについて[527KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00138.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第106回 4/14)医薬品等安全対策部会安全対策調査会(令和7年度第1回 4/14)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
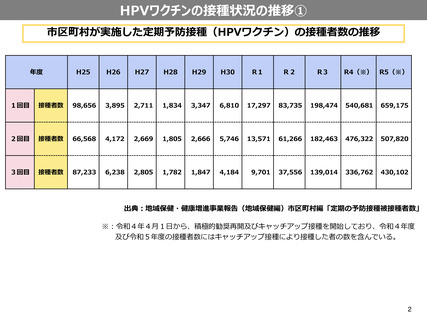
HPVワクチンの接種状況の推移②
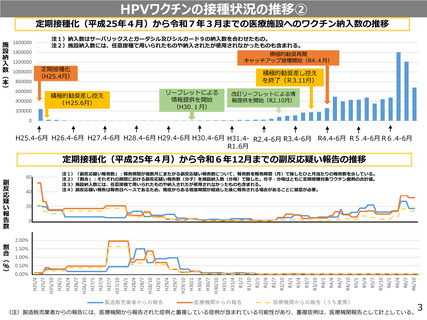
定期接種化(平成25年4月)から令和7年3月までの医療施設へのワクチン納入数の推移
注1)納入数はサーバリックスとガーダシル及びシルガード9の納入数を合わせたもの。
注2)施設納入数には、任意接種で用いられたものや納入されたが使用されなかったものも含まれる。
施 1600000
設 1400000
納
入 1200000
数 1000000
(
本 800000
) 600000
積極的勧奨再開
キャッチアップ接種開始(R4.4月)
定期接種化
(H25.4月)
積極的勧奨差し控え
を終了(R3.11月)
リーフレットによる
情報提供を開始
(H30.1月)
積極的勧奨差し控え
(H25.6月)
400000
200000
改訂リーフレットによる情
報提供を開始(R2.10月)
0
H25.4-6月 H26.4-6月 H27.4-6月 H28.4-6月 H29.4-6月 H30.4-6月 H31.4- R2.4-6月 R3.4-6月 R4.4-6月 R5.4-6月 R6.4-6月
R1.6月
定期接種化(平成25年4月)から令和6年12月までの副反応疑い報告の推移
40
20
0
2.00%
1.50%
1.00%
0.50%
製造販売業者からの報告
R6/10
R6/7
R6/4
R6/1
R5/10
R5/7
R5/4
R5/1
R4/10
R4/7
R4/4
R4/1
R3/10
R3/7
R3/4
R3/1
R2/7
R2/10
R2/4
R2/1
R1/7
医療機関からの報告
R1/10
H31/4
H31/1
H30/7
H30/10
H30/4
H30/1
H29/7
H29/10
H29/4
H29/1
H28/10
H28/7
H28/4
H28/1
H27/10
H27/7
H27/4
H27/1
H26/10
H26/7
H26/4
H26/1
H25/10
0.00%
H25/4
割
合
(
%
)
注1)「副反応疑い報告数」:報告期間が複数月にまたがる副反応疑い報告数について、報告数を報告期間(月)で除したひと月当たりの報告数を示している。
注2)「割合」:それぞれの期間における副反応疑い報告数(分子)を施設納入数(分母)で除した。分子・分母はともに定期接種対象ワクチン製剤の合計値。
注3)施設納入数には、任意接種で用いられたものや納入されたが使用されなかったものも含まれる。
注4)副反応疑い報告は報告日ベースであるため、発症からある程度期間が経過した後に報告される場合があることに留意が必要。
60
H25/7
副
反
応
疑
い
報
告
数
医療機関からの報告(うち重篤)
(注)製造販売業者からの報告には、医療機関から報告された症例と重複している症例が含まれている可能性があり、重複症例は、医療機関報告として計上している。
3
定期接種化(平成25年4月)から令和7年3月までの医療施設へのワクチン納入数の推移
注1)納入数はサーバリックスとガーダシル及びシルガード9の納入数を合わせたもの。
注2)施設納入数には、任意接種で用いられたものや納入されたが使用されなかったものも含まれる。
施 1600000
設 1400000
納
入 1200000
数 1000000
(
本 800000
) 600000
積極的勧奨再開
キャッチアップ接種開始(R4.4月)
定期接種化
(H25.4月)
積極的勧奨差し控え
を終了(R3.11月)
リーフレットによる
情報提供を開始
(H30.1月)
積極的勧奨差し控え
(H25.6月)
400000
200000
改訂リーフレットによる情
報提供を開始(R2.10月)
0
H25.4-6月 H26.4-6月 H27.4-6月 H28.4-6月 H29.4-6月 H30.4-6月 H31.4- R2.4-6月 R3.4-6月 R4.4-6月 R5.4-6月 R6.4-6月
R1.6月
定期接種化(平成25年4月)から令和6年12月までの副反応疑い報告の推移
40
20
0
2.00%
1.50%
1.00%
0.50%
製造販売業者からの報告
R6/10
R6/7
R6/4
R6/1
R5/10
R5/7
R5/4
R5/1
R4/10
R4/7
R4/4
R4/1
R3/10
R3/7
R3/4
R3/1
R2/7
R2/10
R2/4
R2/1
R1/7
医療機関からの報告
R1/10
H31/4
H31/1
H30/7
H30/10
H30/4
H30/1
H29/7
H29/10
H29/4
H29/1
H28/10
H28/7
H28/4
H28/1
H27/10
H27/7
H27/4
H27/1
H26/10
H26/7
H26/4
H26/1
H25/10
0.00%
H25/4
割
合
(
%
)
注1)「副反応疑い報告数」:報告期間が複数月にまたがる副反応疑い報告数について、報告数を報告期間(月)で除したひと月当たりの報告数を示している。
注2)「割合」:それぞれの期間における副反応疑い報告数(分子)を施設納入数(分母)で除した。分子・分母はともに定期接種対象ワクチン製剤の合計値。
注3)施設納入数には、任意接種で用いられたものや納入されたが使用されなかったものも含まれる。
注4)副反応疑い報告は報告日ベースであるため、発症からある程度期間が経過した後に報告される場合があることに留意が必要。
60
H25/7
副
反
応
疑
い
報
告
数
医療機関からの報告(うち重篤)
(注)製造販売業者からの報告には、医療機関から報告された症例と重複している症例が含まれている可能性があり、重複症例は、医療機関報告として計上している。
3