よむ、つかう、まなぶ。
○先進医療会議からの報告について総-1 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00145.html |
| 出典情報 | 中央社会保険医療協議会 総会(第520回 4/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
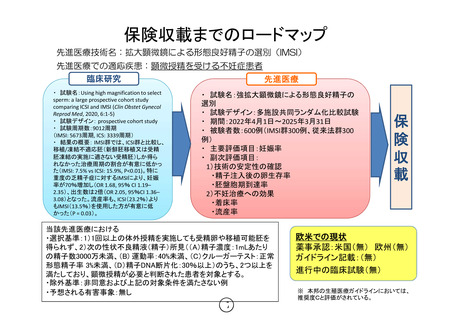
保険収載までのロードマップ
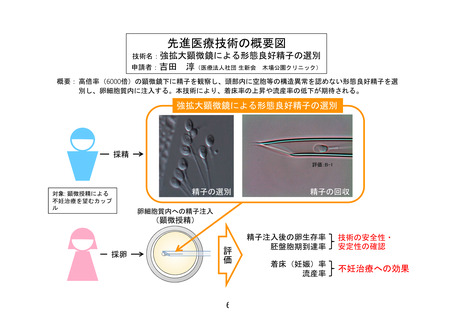
先進医療技術名:拡大顕微鏡による形態良好精子の選別(IMSI)
先進医療での適応疾患:顕微授精を受ける不妊症患者
臨床研究
先進医療
・ 試験名:Using high magnification to select
sperm: a large prospective cohort study
comparing ICSI and IMSI (Clin Obstet Gynecol
Reprod Med, 2020, 6:1-5)
・ 試験デザイン: prospective cohort study
・ 試験周期数:9012周期
(IMSI: 5673周期, ICS: 3339周期)
・ 結果の概要: IMSI群では、ICSI群と比較し、
移植/凍結不適応胚(新鮮胚移植又は受精
胚凍結の実施に適さない受精胚)しか得ら
れなかった治療周期の割合が有意に低かっ
た(IMSI: 7.5% vs ICSI: 15.9%, P<0.01)。特に
重度の乏精子症に対するIMSIにより、妊娠
率が70%増加し(OR 1.68, 95% CI 1.19–
2.35)、出生数は2倍(OR 2.05, 95%CI 1.36–
3.08)となった。流産率も、ICSI(23.2%)より
もIMSI(13.5%)を使用した方が有意に低
かった(P = 0.03)。
・ 試験名:強拡大顕微鏡による形態良好精子の
選別
・ 試験デザイン:多施設共同ランダム化比較試験
・ 期間:2022年4月1日〜2025年3月31日
・ 被験者数:600例(IMSI群300例、従来法群300
例)
・ 主要評価項目:妊娠率
・ 副次評価項目:
1)技術の安定性の確認
・精子注入後の卵生存率
・胚盤胞期到達率
2)不妊治療への効果
・着床率
・流産率
当該先進医療における
・選択基準:1)1回以上の体外授精を実施しても受精卵や移植可能胚を
得られず、2)次の性状不良精液(精子)所見((A)精子濃度:1mLあたり
の精子数3000万未満、(B) 運動率:40%未満、(C)クルーガーテスト:正常
形態精子率 3%未満、(D)精子DNA断片化:30%以上)のうち、2つ以上を
満たしており、顕微授精が必要と判断された患者を対象とする。
・除外基準:非同意および上記の対象条件を満たさない例
・予想される有害事象:無し
7
保
険
収
載
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:(無)
進行中の臨床試験(無)
※ 本邦の生殖医療ガイドラインにおいては、
推奨度Cと評価がされている。
先進医療技術名:拡大顕微鏡による形態良好精子の選別(IMSI)
先進医療での適応疾患:顕微授精を受ける不妊症患者
臨床研究
先進医療
・ 試験名:Using high magnification to select
sperm: a large prospective cohort study
comparing ICSI and IMSI (Clin Obstet Gynecol
Reprod Med, 2020, 6:1-5)
・ 試験デザイン: prospective cohort study
・ 試験周期数:9012周期
(IMSI: 5673周期, ICS: 3339周期)
・ 結果の概要: IMSI群では、ICSI群と比較し、
移植/凍結不適応胚(新鮮胚移植又は受精
胚凍結の実施に適さない受精胚)しか得ら
れなかった治療周期の割合が有意に低かっ
た(IMSI: 7.5% vs ICSI: 15.9%, P<0.01)。特に
重度の乏精子症に対するIMSIにより、妊娠
率が70%増加し(OR 1.68, 95% CI 1.19–
2.35)、出生数は2倍(OR 2.05, 95%CI 1.36–
3.08)となった。流産率も、ICSI(23.2%)より
もIMSI(13.5%)を使用した方が有意に低
かった(P = 0.03)。
・ 試験名:強拡大顕微鏡による形態良好精子の
選別
・ 試験デザイン:多施設共同ランダム化比較試験
・ 期間:2022年4月1日〜2025年3月31日
・ 被験者数:600例(IMSI群300例、従来法群300
例)
・ 主要評価項目:妊娠率
・ 副次評価項目:
1)技術の安定性の確認
・精子注入後の卵生存率
・胚盤胞期到達率
2)不妊治療への効果
・着床率
・流産率
当該先進医療における
・選択基準:1)1回以上の体外授精を実施しても受精卵や移植可能胚を
得られず、2)次の性状不良精液(精子)所見((A)精子濃度:1mLあたり
の精子数3000万未満、(B) 運動率:40%未満、(C)クルーガーテスト:正常
形態精子率 3%未満、(D)精子DNA断片化:30%以上)のうち、2つ以上を
満たしており、顕微授精が必要と判断された患者を対象とする。
・除外基準:非同意および上記の対象条件を満たさない例
・予想される有害事象:無し
7
保
険
収
載
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:(無)
進行中の臨床試験(無)
※ 本邦の生殖医療ガイドラインにおいては、
推奨度Cと評価がされている。