よむ、つかう、まなぶ。
参考資料1○患者申出療養の中間報告について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
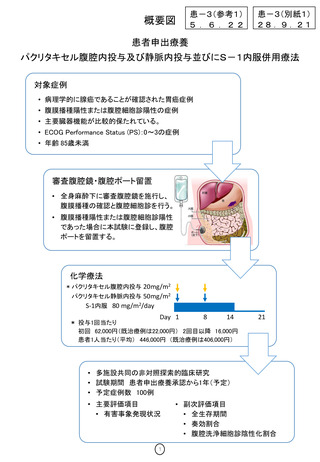
概要図
患-3(参考1)
5 . 6 . 2 2
患-3(別紙1)
28.9.21
患者申出療養
パクリタキセル腹腔内投与及び静脈内投与並びにS-1内服併用療法
対象症例
• 病理学的に腺癌であることが確認された胃癌症例
• 腹膜播種陽性または腹腔細胞診陽性の症例
• 主要臓器機能が比較的保たれている。
• ECOG Performance Status (PS):0~3の症例
• 年齢 85歳未満
審査腹腔鏡・腹腔ポート留置
• 全身麻酔下に審査腹腔鏡を施行し、
腹膜播種の確認と腹腔細胞診を行う。
• 腹膜播種陽性または腹腔細胞診陽性
であった場合に本試験に登録し、腹腔
ポートを留置する。
化学療法
* パクリタキセル腹腔内投与 20mg/m2
パクリタキセル静脈内投与 50mg/m2
S-1内服 80 mg/m2/day
Day 1
8
14
* 投与1回当たり
初回 62,000円(既治療例は22,000円) 2回目以降 16,000円
患者1人当たり(平均) 446,000円 (既治療例は406,000円)
21
• 多施設共同の非対照探索的臨床研究
• 試験期間 患者申出療養承認から1年(予定)
• 予定症例数 100例
• 主要評価項目
• 有害事象発現状況
1
• 副次評価項目
• 全生存期間
• 奏効割合
• 腹腔洗浄細胞診陰性化割合
患-3(参考1)
5 . 6 . 2 2
患-3(別紙1)
28.9.21
患者申出療養
パクリタキセル腹腔内投与及び静脈内投与並びにS-1内服併用療法
対象症例
• 病理学的に腺癌であることが確認された胃癌症例
• 腹膜播種陽性または腹腔細胞診陽性の症例
• 主要臓器機能が比較的保たれている。
• ECOG Performance Status (PS):0~3の症例
• 年齢 85歳未満
審査腹腔鏡・腹腔ポート留置
• 全身麻酔下に審査腹腔鏡を施行し、
腹膜播種の確認と腹腔細胞診を行う。
• 腹膜播種陽性または腹腔細胞診陽性
であった場合に本試験に登録し、腹腔
ポートを留置する。
化学療法
* パクリタキセル腹腔内投与 20mg/m2
パクリタキセル静脈内投与 50mg/m2
S-1内服 80 mg/m2/day
Day 1
8
14
* 投与1回当たり
初回 62,000円(既治療例は22,000円) 2回目以降 16,000円
患者1人当たり(平均) 446,000円 (既治療例は406,000円)
21
• 多施設共同の非対照探索的臨床研究
• 試験期間 患者申出療養承認から1年(予定)
• 予定症例数 100例
• 主要評価項目
• 有害事象発現状況
1
• 副次評価項目
• 全生存期間
• 奏効割合
• 腹腔洗浄細胞診陰性化割合