よむ、つかう、まなぶ。
参考資料3-2 ゾコーバ錠 添付文書 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34324.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 医薬品等安全対策部会 安全対策調査会(令和5年度第4回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ゾコーバ錠(4
)
薬剤名等
ボセンタン水和物
臨床症状・措置方法
機序・危険因子
本剤の血中濃度が減少
し、作用が減弱するお
それがある。また、ボ
センタン水和物の血中
濃度が上昇し、副作用
が発現しやすくなるお
それがある。
ボセンタン水和物の
CYP3A誘 導 作 用 に よ
り、本剤の代謝が促進
されるおそれがある。
また、本剤の CYP3Aに
対する阻害作用によ
り、ボセンタン水和物
の代謝が阻害される。
本剤の血中濃度が減少 これらの薬剤の CYP3A
中程度の C
Y
P
3
A誘導剤
エファビレンツ、エト し、作用が減弱するお 誘導作用により、本剤
の代謝が促進されるお
ラビリン、フェノバル それがある。
ビタール、プリミドン
それがある。
等
メトトレキサート
メトトレキサートの血
中濃度を上昇させ、中
毒症状(口内炎、汎血
球減少)が発現するお
それがある。
i
nv
i
t
r
o試験より本剤
は OAT3阻害作用を有
することが示唆されて
おり、メトトレキサー
トの尿中排出を遅延さ
せるおそれがある。
表1
6
1 反復投与時の薬物動態パラメータ
投与日
例数
※1
C
m
a
x
(
μg
/
m
L
)
※2
T
m
a
x
(
h
r
)
※1
A
U
C
0
τ
(
μg
・h
r
/
m
L
)
※1
T
1
/
2
(
h
r
)
1日目
8
2
2
.
3
(
1
4
.
8
)
2
.
5
0
(
1
.
5
0
,8
.
0
0
)
3
7
2
.
9
(
1
2
.
0
)
-
5日目
7
2
8
.
1
(
1
5
.
6
)
2
.
0
0
(
1
.
0
0
,8
.
0
0
)
5
1
8
.
3
(
1
3
.
0
)
5
1
.
4
(
1
9
.
0
)
1
1
.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異
常が認められた場合には投与を中止するなど適切な処置を行うこ
と。
11.1重大な副作用
※1
:幾何平均値(%
変動係数)
※2
:中央値(最小値、最大値)
**11.1.1アナフィラキシー(頻度不明)
1
6
.
2吸収
11.2その他の副作用
種類\頻度
5
%
以上
1
〜5
%
未満
1
%
未満
過敏症
発疹
消化器
悪心、嘔吐、下
痢、腹部不快感
精神神経系
1
6
.
2
.
1食事の影響
頻度不明
健康成人 14例に本剤(エンシトレルビルとして 375mg)を空腹
そう痒
時又は高脂肪・高カロリー食摂取後に単回経口投与注したときの
6
2に示す。
薬物動態パラメータ 3)を表 1
頭痛
代謝
脂質異常症
その他
HDLコ レ ス テ トリグリセリド 血清鉄上昇
ロ ー ル 低 下 上昇、ビリルビ
ン上昇、血中コ
(1
6
.
6
%
)
レステロール低
下
表1
6
2 3
7
5
m
g単回投与時注の薬物動態パラメータ
1
4
.適用上の注意
食事
条件
例数
※1
C
m
a
x
(
μg
/
m
L
)
※2
T
m
a
x
(
h
r
)
※1
A
U
C
0
i
n
f
(
μg
・h
r
/
m
L
)
空腹時
1
3
2
1
.
4
(
2
3
.
5
)
2
.
5
0
(
1
.
5
0
,4
.
0
0
)
1
2
3
6
(
2
3
.
2
)
食後※3
1
4
2
0
.
0
(
1
6
.
4
)
6
.
0
0
(
1
.
5
0
,1
6
.
0
0
)
1
5
3
8
(
1
5
.
8
)
※1
:幾何平均値(%
変動係数)
※2
:中央値(最小値、最大値)
※3
:高脂肪・高カロリー食
14.1薬剤交付時の注意
PTP包装の薬剤は PTPシートから取り出して服用するよう指導す
1
6
.
3分布
ること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入
エンシトレルビルのヒト血清蛋白結合率は、97.7〜98.7%であっ
し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発する
nv
i
t
r
o
)
。
た 4)(i
ことがある。
1
6
.
4代謝
1
5
.その他の注意
健康成人にエンシトレルビル
15.2非臨床試験に基づく情報
与注したとき、血漿中では主に未変化のエンシトレルビルが検出
フマル酸(懸濁剤)を単回経口投
カニクイザルに本薬を 2又は 4週間反復経口投与した毒性試験に
され、代謝物としてエンシトレルビルのクロル付加体が検出され
おいて、臨床曝露量の 8倍相当以上で、肝臓門脈、胆嚢、肺/気
た。尿中では主に未変化のエンシトレルビルが検出され、代謝物
管支等に単核細胞主体の炎症性細胞浸潤が認められている 1)。
としてエンシトレルビルのトリアゾール脱メチル体が検出され
た 5)。
1
6
.薬物動態
また、i
nv
i
t
r
o代謝試験の結果、尿中の代謝物であるエンシトレ
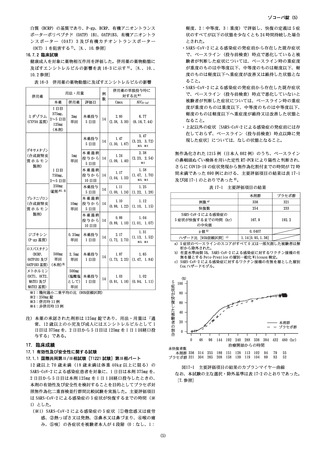
16.1血中濃度
ルビルのトリアゾール脱メチル体は、CYP3Aを含む複数の CYP分
健康成人女性 8例に本剤を 5日間空腹時反復経口投与した(エン
子種により生成されると推定された 6)。
シ ト レ ル ビ ル と し て 1日 目 は 375mg、 2日 目 か ら 5日 目 は
1
6
.5排泄
125mg)ときの血漿中濃度推移を図 16-1に、薬物動態パラメー
健康成人男性 20例にエンシトレルビル
-1に示す。
タ 2)を表 16
フマル酸(懸濁剤)を
エンシトレルビルとして 250〜1000mgで空腹時単回経口投与注し
たときの、投与後 144時間までの尿中排泄率は 16.0〜21.8%で
あった 5)。
1
6
.
7薬物相互作用
1
6
.
7
.
1I
nv
i
t
r
o試験
エンシトレルビルは CYP3Aを時間依存的に阻害し、CYP2B6及び
C
Y
P
3
Aを誘導する。
また、エンシトレルビルは P糖蛋白質(P-gp)及び乳がん耐性蛋
(4
)
)
薬剤名等
ボセンタン水和物
臨床症状・措置方法
機序・危険因子
本剤の血中濃度が減少
し、作用が減弱するお
それがある。また、ボ
センタン水和物の血中
濃度が上昇し、副作用
が発現しやすくなるお
それがある。
ボセンタン水和物の
CYP3A誘 導 作 用 に よ
り、本剤の代謝が促進
されるおそれがある。
また、本剤の CYP3Aに
対する阻害作用によ
り、ボセンタン水和物
の代謝が阻害される。
本剤の血中濃度が減少 これらの薬剤の CYP3A
中程度の C
Y
P
3
A誘導剤
エファビレンツ、エト し、作用が減弱するお 誘導作用により、本剤
の代謝が促進されるお
ラビリン、フェノバル それがある。
ビタール、プリミドン
それがある。
等
メトトレキサート
メトトレキサートの血
中濃度を上昇させ、中
毒症状(口内炎、汎血
球減少)が発現するお
それがある。
i
nv
i
t
r
o試験より本剤
は OAT3阻害作用を有
することが示唆されて
おり、メトトレキサー
トの尿中排出を遅延さ
せるおそれがある。
表1
6
1 反復投与時の薬物動態パラメータ
投与日
例数
※1
C
m
a
x
(
μg
/
m
L
)
※2
T
m
a
x
(
h
r
)
※1
A
U
C
0
τ
(
μg
・h
r
/
m
L
)
※1
T
1
/
2
(
h
r
)
1日目
8
2
2
.
3
(
1
4
.
8
)
2
.
5
0
(
1
.
5
0
,8
.
0
0
)
3
7
2
.
9
(
1
2
.
0
)
-
5日目
7
2
8
.
1
(
1
5
.
6
)
2
.
0
0
(
1
.
0
0
,8
.
0
0
)
5
1
8
.
3
(
1
3
.
0
)
5
1
.
4
(
1
9
.
0
)
1
1
.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異
常が認められた場合には投与を中止するなど適切な処置を行うこ
と。
11.1重大な副作用
※1
:幾何平均値(%
変動係数)
※2
:中央値(最小値、最大値)
**11.1.1アナフィラキシー(頻度不明)
1
6
.
2吸収
11.2その他の副作用
種類\頻度
5
%
以上
1
〜5
%
未満
1
%
未満
過敏症
発疹
消化器
悪心、嘔吐、下
痢、腹部不快感
精神神経系
1
6
.
2
.
1食事の影響
頻度不明
健康成人 14例に本剤(エンシトレルビルとして 375mg)を空腹
そう痒
時又は高脂肪・高カロリー食摂取後に単回経口投与注したときの
6
2に示す。
薬物動態パラメータ 3)を表 1
頭痛
代謝
脂質異常症
その他
HDLコ レ ス テ トリグリセリド 血清鉄上昇
ロ ー ル 低 下 上昇、ビリルビ
ン上昇、血中コ
(1
6
.
6
%
)
レステロール低
下
表1
6
2 3
7
5
m
g単回投与時注の薬物動態パラメータ
1
4
.適用上の注意
食事
条件
例数
※1
C
m
a
x
(
μg
/
m
L
)
※2
T
m
a
x
(
h
r
)
※1
A
U
C
0
i
n
f
(
μg
・h
r
/
m
L
)
空腹時
1
3
2
1
.
4
(
2
3
.
5
)
2
.
5
0
(
1
.
5
0
,4
.
0
0
)
1
2
3
6
(
2
3
.
2
)
食後※3
1
4
2
0
.
0
(
1
6
.
4
)
6
.
0
0
(
1
.
5
0
,1
6
.
0
0
)
1
5
3
8
(
1
5
.
8
)
※1
:幾何平均値(%
変動係数)
※2
:中央値(最小値、最大値)
※3
:高脂肪・高カロリー食
14.1薬剤交付時の注意
PTP包装の薬剤は PTPシートから取り出して服用するよう指導す
1
6
.
3分布
ること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入
エンシトレルビルのヒト血清蛋白結合率は、97.7〜98.7%であっ
し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発する
nv
i
t
r
o
)
。
た 4)(i
ことがある。
1
6
.
4代謝
1
5
.その他の注意
健康成人にエンシトレルビル
15.2非臨床試験に基づく情報
与注したとき、血漿中では主に未変化のエンシトレルビルが検出
フマル酸(懸濁剤)を単回経口投
カニクイザルに本薬を 2又は 4週間反復経口投与した毒性試験に
され、代謝物としてエンシトレルビルのクロル付加体が検出され
おいて、臨床曝露量の 8倍相当以上で、肝臓門脈、胆嚢、肺/気
た。尿中では主に未変化のエンシトレルビルが検出され、代謝物
管支等に単核細胞主体の炎症性細胞浸潤が認められている 1)。
としてエンシトレルビルのトリアゾール脱メチル体が検出され
た 5)。
1
6
.薬物動態
また、i
nv
i
t
r
o代謝試験の結果、尿中の代謝物であるエンシトレ
16.1血中濃度
ルビルのトリアゾール脱メチル体は、CYP3Aを含む複数の CYP分
健康成人女性 8例に本剤を 5日間空腹時反復経口投与した(エン
子種により生成されると推定された 6)。
シ ト レ ル ビ ル と し て 1日 目 は 375mg、 2日 目 か ら 5日 目 は
1
6
.5排泄
125mg)ときの血漿中濃度推移を図 16-1に、薬物動態パラメー
健康成人男性 20例にエンシトレルビル
-1に示す。
タ 2)を表 16
フマル酸(懸濁剤)を
エンシトレルビルとして 250〜1000mgで空腹時単回経口投与注し
たときの、投与後 144時間までの尿中排泄率は 16.0〜21.8%で
あった 5)。
1
6
.
7薬物相互作用
1
6
.
7
.
1I
nv
i
t
r
o試験
エンシトレルビルは CYP3Aを時間依存的に阻害し、CYP2B6及び
C
Y
P
3
Aを誘導する。
また、エンシトレルビルは P糖蛋白質(P-gp)及び乳がん耐性蛋
(4
)