よむ、つかう、まなぶ。
参考資料3 <改訂案>副反応疑い報告書 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00063.html |
| 出典情報 | 第95回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和5年度第7回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)() |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
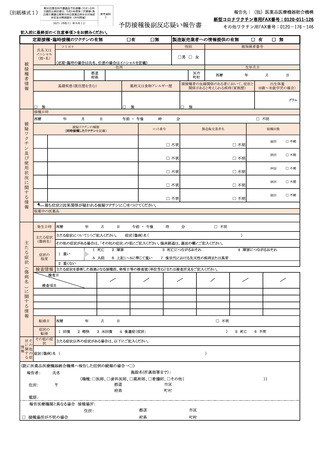
臨床経過
載にあたっての |検査値は前真の検査値欄にご記入ください。
留意事項 個人の特定つながる情報(氏名等)は記入しないでください。
由
く注意事項>
報告に当たっては、 記入要領を参考に、記入してください。
報告書中の「症状名」には、原則として医学的に認められている症状名を記載してください。
報告時点で、記載された症状が未回復である場合には「未回復」の欄に、記載された症状による障害等がある場合には「後遣症」の欄に記載してください。
報告基準中の「その他の反応」については、①入院、②死詞又は永続的な機能不全に陥る又は陥るおそれがある場合でらって、それが予防接種を受けたことによ
るものと疑われる症状について、 報告してください。
人 それが予防接種を受けたことによるものと上疑われる症状については、「その他の反応」として報告
してく こ い。
いい 予防接種後に一定の期間内に現れた症状を報告するためのものであり、予防接種との因果関係や予防接種健康被害救済と直接に結びつくもので
はありません。
報告された情報については、厚生労働省、 国立感染症研究所、独立行政法人医薬品医療機器総合機構で共有します。 また、 患者(被接種者)氏名、生年月日を
除いた情報を、製造販売業者に提供します。 報告を行った医療機関等に対し、医薬品医療機器総合機構文は製造販売業者が詳細調査を行う場合があります。
報告された情報については、ワクチンの安全対策の一環として、 広く情報を公表することがありますが、その場合には、施設名及び患者のプライバシー等に関する
部分は除きます。
患者に予防接種を行った医師等以外の医師等も予防接種を受けたことによるものと疑われる症状を知った場合には報告を行う5のとされています。 なお、 報告いた
だく場合においては、把握が困難な事項については、 記載いただかなくて結構です。
独立行政法人医薬品医療機器総合機構ウェブサイト上にて報告に係る記入要領を示しているため、 報告にあたっては参照してください。
電子報告システム(報告受付サイト) による報告は、以下の独立行政法人医薬品医療機器総合機構ウェブサイトよりアクセスし、 報告を作成、提出してください。
URL :https://www.pmda.go.jp/safety/reports/hcp/0002.html
FAXでの報告は、独立行政法人医薬品医療機器総合機構の下記宛に送付してください。
新型コロナワクチン専用FAX番号:0120-011-126
その他のワクチン用FAX番号 :0120-176-146
載にあたっての |検査値は前真の検査値欄にご記入ください。
留意事項 個人の特定つながる情報(氏名等)は記入しないでください。
由
く注意事項>
報告に当たっては、 記入要領を参考に、記入してください。
報告書中の「症状名」には、原則として医学的に認められている症状名を記載してください。
報告時点で、記載された症状が未回復である場合には「未回復」の欄に、記載された症状による障害等がある場合には「後遣症」の欄に記載してください。
報告基準中の「その他の反応」については、①入院、②死詞又は永続的な機能不全に陥る又は陥るおそれがある場合でらって、それが予防接種を受けたことによ
るものと疑われる症状について、 報告してください。
人 それが予防接種を受けたことによるものと上疑われる症状については、「その他の反応」として報告
してく こ い。
いい 予防接種後に一定の期間内に現れた症状を報告するためのものであり、予防接種との因果関係や予防接種健康被害救済と直接に結びつくもので
はありません。
報告された情報については、厚生労働省、 国立感染症研究所、独立行政法人医薬品医療機器総合機構で共有します。 また、 患者(被接種者)氏名、生年月日を
除いた情報を、製造販売業者に提供します。 報告を行った医療機関等に対し、医薬品医療機器総合機構文は製造販売業者が詳細調査を行う場合があります。
報告された情報については、ワクチンの安全対策の一環として、 広く情報を公表することがありますが、その場合には、施設名及び患者のプライバシー等に関する
部分は除きます。
患者に予防接種を行った医師等以外の医師等も予防接種を受けたことによるものと疑われる症状を知った場合には報告を行う5のとされています。 なお、 報告いた
だく場合においては、把握が困難な事項については、 記載いただかなくて結構です。
独立行政法人医薬品医療機器総合機構ウェブサイト上にて報告に係る記入要領を示しているため、 報告にあたっては参照してください。
電子報告システム(報告受付サイト) による報告は、以下の独立行政法人医薬品医療機器総合機構ウェブサイトよりアクセスし、 報告を作成、提出してください。
URL :https://www.pmda.go.jp/safety/reports/hcp/0002.html
FAXでの報告は、独立行政法人医薬品医療機器総合機構の下記宛に送付してください。
新型コロナワクチン専用FAX番号:0120-011-126
その他のワクチン用FAX番号 :0120-176-146