よむ、つかう、まなぶ。
参考資料○患者申出療養の定期報告等について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00027.html |
| 出典情報 | 患者申出療養評価会議(第44回 10/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
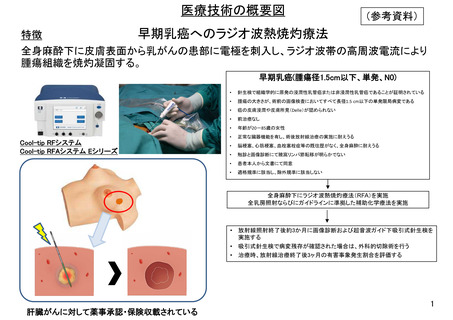
保険収載に至るロードマップ
試験機器名
:Cool-tip RFAシステム Eシリーズ・Cool-tip RFシステム
【患者申出療養】
早期乳癌へのラジオ波熱焼灼療法の安全性の検証と手技の標準化に向けた多施設
共同研究
対象:早期乳癌
目的:患者の申出に応えつつ、未だ薬事承認・保険収載の可否判断を行うに
は有効性・安全性の根拠が十分でない、評価の定まっていない治療法の、本
邦での実施可能性・安全性プロファイルの確認を行う。
評価項目: 主要; 治療時有害事象割合、副次; 不完全焼灼割合(術後および放
射線治療終了後3ヶ月)、プロトコール治療完了割合
予定登録期間: 6年間
実施医療機関:1) 医療法上の臨床研究中核病院もしくは都道府県がん診療連携
拠点病院、 2)日本乳癌学会認定施設 、3)重篤な有害事象が発生した場合、24時間、
365日適切に対応できる体制が確保されている、4)先進医療Bまたは高度医療で実
施した臨床試験の参加施設、または試験実施医師が所属する施設
多施設実施での安全性上の問題等で、
実施継続が不適切と考えられた場合
患者申出療養の取り下げ
保
険
収
載
多施設での実施の
安全性および
医療上の必要性が
認められた場合
先進医療B
・試験名:早期乳癌へのラジオ波熱焼
灼療法の有効性の検証と手技・観察
の標準化に向けた多施設共同研究
•試験デザイン:前向き単一群非ランダ
ム化検証的研究
•期間:2013年8月登録開始~2017年
11月末登録終了。総研究期間:10年間
(登録期間5年、追跡期間5年)
2022年12月 追跡終了予定
•被験者数: 372例
•評価項目: 温存乳房内再発率、治療
後病変残存率、全生存率、遠隔再発
率、有害事象
欧米での現状
Cool-tip RFシステム:
肝腫瘍、類骨骨腫、肺がん、腎がん等に対して使用されている。
Cool-tip RFAシステムEシリーズ:
肝腫瘍、類骨骨腫、肺がん、腎がん等に対して使用されている。なお、
米国では本機器の承認を取得していない。
ガイドライン記載: 無
進行中の臨床試験: 無
有用性が認められた場合
当該患者申出療養における選択基準:
浸潤性または非浸潤性乳管癌、長径
1.5cm以下、年齢20-85歳、放射線治療
耐術可能、腋窩リンパ節転移がない
等
除外基準:広範囲の乳管内病変や多発
病変、マンモグラフィでの広範な石灰
化、温存乳房内再発例、術前治療例、
男性乳癌等
予想される有害事象:皮膚・大胸筋熱
傷、止血困難な出血、病変部血腫、局
所感染、制御不能の疼痛、乳頭・乳輪
の変形 等
薬
事
承
認
企業申請へ
医療とし
ての有用
性が認め
られな
かった場
合
開発
中止
2
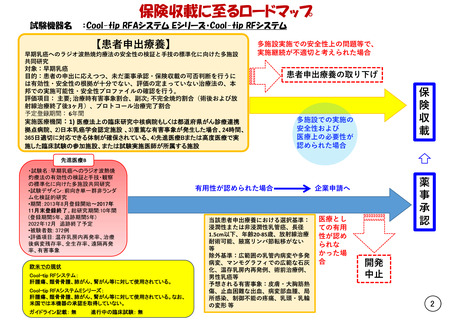
試験機器名
:Cool-tip RFAシステム Eシリーズ・Cool-tip RFシステム
【患者申出療養】
早期乳癌へのラジオ波熱焼灼療法の安全性の検証と手技の標準化に向けた多施設
共同研究
対象:早期乳癌
目的:患者の申出に応えつつ、未だ薬事承認・保険収載の可否判断を行うに
は有効性・安全性の根拠が十分でない、評価の定まっていない治療法の、本
邦での実施可能性・安全性プロファイルの確認を行う。
評価項目: 主要; 治療時有害事象割合、副次; 不完全焼灼割合(術後および放
射線治療終了後3ヶ月)、プロトコール治療完了割合
予定登録期間: 6年間
実施医療機関:1) 医療法上の臨床研究中核病院もしくは都道府県がん診療連携
拠点病院、 2)日本乳癌学会認定施設 、3)重篤な有害事象が発生した場合、24時間、
365日適切に対応できる体制が確保されている、4)先進医療Bまたは高度医療で実
施した臨床試験の参加施設、または試験実施医師が所属する施設
多施設実施での安全性上の問題等で、
実施継続が不適切と考えられた場合
患者申出療養の取り下げ
保
険
収
載
多施設での実施の
安全性および
医療上の必要性が
認められた場合
先進医療B
・試験名:早期乳癌へのラジオ波熱焼
灼療法の有効性の検証と手技・観察
の標準化に向けた多施設共同研究
•試験デザイン:前向き単一群非ランダ
ム化検証的研究
•期間:2013年8月登録開始~2017年
11月末登録終了。総研究期間:10年間
(登録期間5年、追跡期間5年)
2022年12月 追跡終了予定
•被験者数: 372例
•評価項目: 温存乳房内再発率、治療
後病変残存率、全生存率、遠隔再発
率、有害事象
欧米での現状
Cool-tip RFシステム:
肝腫瘍、類骨骨腫、肺がん、腎がん等に対して使用されている。
Cool-tip RFAシステムEシリーズ:
肝腫瘍、類骨骨腫、肺がん、腎がん等に対して使用されている。なお、
米国では本機器の承認を取得していない。
ガイドライン記載: 無
進行中の臨床試験: 無
有用性が認められた場合
当該患者申出療養における選択基準:
浸潤性または非浸潤性乳管癌、長径
1.5cm以下、年齢20-85歳、放射線治療
耐術可能、腋窩リンパ節転移がない
等
除外基準:広範囲の乳管内病変や多発
病変、マンモグラフィでの広範な石灰
化、温存乳房内再発例、術前治療例、
男性乳癌等
予想される有害事象:皮膚・大胸筋熱
傷、止血困難な出血、病変部血腫、局
所感染、制御不能の疼痛、乳頭・乳輪
の変形 等
薬
事
承
認
企業申請へ
医療とし
ての有用
性が認め
られな
かった場
合
開発
中止
2