よむ、つかう、まなぶ。
資料2-3 申請技術の概要及びロードマップ (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37624.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第158回 2/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
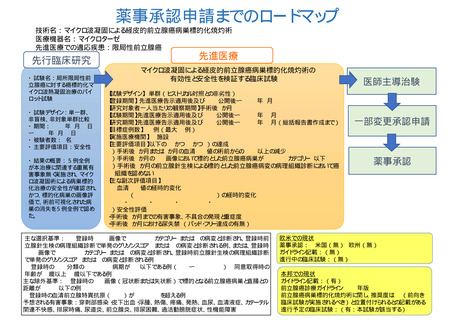
薬事承認申請までのロードマップ
技術名:マイクロ波凝固による経皮的前立腺癌病巣標的化焼灼術
医療機器名:マイクロターゼAFM-712
先進医療での適応疾患:限局性前立腺癌
先行臨床研究
・ 試験名:局所限局性前
立腺癌に対する癌標的化マ
イクロ波熱凝固治療のパイ
ロット試験
・ 試験デザイン:単一群、
非盲検、非対象単群比較
・ 期間:2019年6月17日
〜2021年6月11日
・ 被験者数:5名
・ 主要評価項目:安全性
・ 結果の概要:5例全例
が本治療に関連する重篤有
害事象無く実施され、マイク
ロ波凝固術による病巣標的
化治療の安全性が確認され、
かつ、標的化病巣の画像評
価で、術前可視化された病
巣の消失を5例全例で認め
た。
先進医療B
マイクロ波凝固による経皮的前立腺癌病巣標的化焼灼術の
有効性と安全性を検証する臨床試験
【試験デザイン】 単群(ヒストリカル対照との非劣性)
【登録期間】 先進医療告示適用後及びjRCT公開後〜2026年4月
【研究対象者一人当たりの観察期間】手術後6か月
【試験期間】先進医療告示適用後及びjRCT公開後〜 2026年10月
【研究期間】先進医療告示適用後及びjRCT公開後〜 2027年10月(総括報告書作成まで)
【目標症例数】 65例(最大73例)
【実施医療機関】 8施設
【主要評価項目】以下の1) かつ2) かつ3)の達成
1)手術後3か月または6か月の血清PSA値の術前からの50%以上の減少
2)手術後6か月のMRI画像において標的とした前立腺癌病巣がPI-RADSカテゴリー3以下
3)手術後6か月の前立腺針生検による標的とした前立腺癌病変の病理組織診断において癌
組織を認めない
【主な副次評価項目】
1) 血清PSA値の経時的変化
2) PRO(Patient Reported Outcomes)の経時的変化
・EPIC ・SF12 ・IIEF-15 ・EQ5D
3)安全性評価
・手術後6か月までの有害事象、不具合の発現と重症度
・手術後6か月における尿失禁 (パッド・フリー達成の有無)
主な選択基準: 1) 登録時 MRI 画像で PI-RADS カテゴリー3または4 の病変と診断され、登録時前
立腺針生検の病理組織診断で単発のグリソンスコア 7または8 の病変と診断される例、または、登録時
MRI 画像で PI-RADS カテゴリー4または5 の病変と診断され、登録時前立腺針生検の病理組織診断
で単発のグリソンスコア 6または7 の病変と診断される例
2)登録時のTNM分類のclinical T 病期がT2c以下である例(T1a〜T2cN0M0)3)同意取得時の
年齢が20歳以上85歳以下である例
主な除外基準:1)登録時のMRI画像(冠状断または矢状断)で標的となる前立腺癌病巣と直腸との
距離が10mm以下の例
2)登録時の血清前立腺特異抗原(PSA)が20 ng/mlを超える例
予想される有害事象:穿刺部感染・皮下出血・浮腫、熱傷、疼痛、発熱、血尿、血清液症、カテーテル
関連不快感、排尿時痛、尿道炎、前立腺炎、排尿困難、過活動膀胱症状、性機能障害
医師主導治験
一部変更承認申請
薬事承認
欧米での現状
薬事承認: 米国(無) 欧州(無)
ガイドライン記載:(無)
進行中の臨床試験:(無)
本邦での現状
ガイドライン記載:(有)
前立腺癌診療ガイドライン2023年版
前立腺癌病巣標的化焼灼術に関し、推奨度はC1(前向き
臨床試験が実施されるべき)と位置付けられるとの記載がある
1
進行予定の臨床試験:(有:本試験が該当する)
技術名:マイクロ波凝固による経皮的前立腺癌病巣標的化焼灼術
医療機器名:マイクロターゼAFM-712
先進医療での適応疾患:限局性前立腺癌
先行臨床研究
・ 試験名:局所限局性前
立腺癌に対する癌標的化マ
イクロ波熱凝固治療のパイ
ロット試験
・ 試験デザイン:単一群、
非盲検、非対象単群比較
・ 期間:2019年6月17日
〜2021年6月11日
・ 被験者数:5名
・ 主要評価項目:安全性
・ 結果の概要:5例全例
が本治療に関連する重篤有
害事象無く実施され、マイク
ロ波凝固術による病巣標的
化治療の安全性が確認され、
かつ、標的化病巣の画像評
価で、術前可視化された病
巣の消失を5例全例で認め
た。
先進医療B
マイクロ波凝固による経皮的前立腺癌病巣標的化焼灼術の
有効性と安全性を検証する臨床試験
【試験デザイン】 単群(ヒストリカル対照との非劣性)
【登録期間】 先進医療告示適用後及びjRCT公開後〜2026年4月
【研究対象者一人当たりの観察期間】手術後6か月
【試験期間】先進医療告示適用後及びjRCT公開後〜 2026年10月
【研究期間】先進医療告示適用後及びjRCT公開後〜 2027年10月(総括報告書作成まで)
【目標症例数】 65例(最大73例)
【実施医療機関】 8施設
【主要評価項目】以下の1) かつ2) かつ3)の達成
1)手術後3か月または6か月の血清PSA値の術前からの50%以上の減少
2)手術後6か月のMRI画像において標的とした前立腺癌病巣がPI-RADSカテゴリー3以下
3)手術後6か月の前立腺針生検による標的とした前立腺癌病変の病理組織診断において癌
組織を認めない
【主な副次評価項目】
1) 血清PSA値の経時的変化
2) PRO(Patient Reported Outcomes)の経時的変化
・EPIC ・SF12 ・IIEF-15 ・EQ5D
3)安全性評価
・手術後6か月までの有害事象、不具合の発現と重症度
・手術後6か月における尿失禁 (パッド・フリー達成の有無)
主な選択基準: 1) 登録時 MRI 画像で PI-RADS カテゴリー3または4 の病変と診断され、登録時前
立腺針生検の病理組織診断で単発のグリソンスコア 7または8 の病変と診断される例、または、登録時
MRI 画像で PI-RADS カテゴリー4または5 の病変と診断され、登録時前立腺針生検の病理組織診断
で単発のグリソンスコア 6または7 の病変と診断される例
2)登録時のTNM分類のclinical T 病期がT2c以下である例(T1a〜T2cN0M0)3)同意取得時の
年齢が20歳以上85歳以下である例
主な除外基準:1)登録時のMRI画像(冠状断または矢状断)で標的となる前立腺癌病巣と直腸との
距離が10mm以下の例
2)登録時の血清前立腺特異抗原(PSA)が20 ng/mlを超える例
予想される有害事象:穿刺部感染・皮下出血・浮腫、熱傷、疼痛、発熱、血尿、血清液症、カテーテル
関連不快感、排尿時痛、尿道炎、前立腺炎、排尿困難、過活動膀胱症状、性機能障害
医師主導治験
一部変更承認申請
薬事承認
欧米での現状
薬事承認: 米国(無) 欧州(無)
ガイドライン記載:(無)
進行中の臨床試験:(無)
本邦での現状
ガイドライン記載:(有)
前立腺癌診療ガイドライン2023年版
前立腺癌病巣標的化焼灼術に関し、推奨度はC1(前向き
臨床試験が実施されるべき)と位置付けられるとの記載がある
1
進行予定の臨床試験:(有:本試験が該当する)