よむ、つかう、まなぶ。
【資料2】医薬・生活衛生局からの定期報告 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
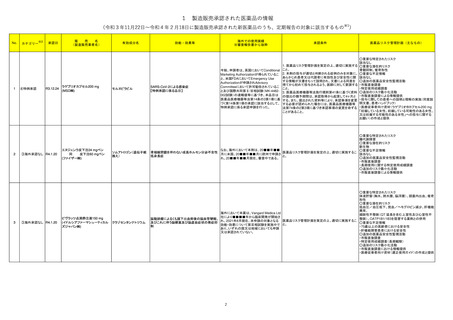
製造販売承認された医薬品の情報
(令和3年11月22日~令和4年2月18日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
3
カテゴリー
④特例承認
※2
承認日
R3.12.24
③海外承認なし R4.1.20
③海外承認なし R4.1.20
販
売
名
(製造販売業者名)
ラゲブリオカプセル200 mg
(MSD㈱)
エヌジェンラ皮下注24 mgペン
同
皮下注60 mgペン
(ファイザー㈱)
ピヴラッツ点滴静注液150 mg
(イドルシアファーマシューティカル
ズジャパン㈱)
有効成分名
海外での使用実績
※審査報告書から抜粋
効能・効果等
今般、申請者は、英国においてConditional
Marketing Authorizationが得られているこ
と、米国FDAにおいてEmergency Use
Authorizationが申請されAdvisory
Committeeにおいて許可勧告されているこ
と及び国際共同第Ⅱ/Ⅲ相試験(MK-4482002試験)の速報値等に基づき、本品目は
医薬品医療機器等法第14条の3第1項に基
づく第14条第1項の承認に該当するとして、
特例承認に係る承認申請を行った。
承認条件
医薬品リスク管理計画(主なもの)
1. 医薬品リスク管理計画を策定の上、適切に実施する
こと。
2. 本剤の投与が適切と判断される症例のみを対象に、
あらかじめ患者又は代諾者に有効性及び安全性に関
する情報が文書をもって説明され、文書による同意を
得てから初めて投与されるよう、医師に対して要請する
こと。
3. 医薬品医療機器等法施行規則第41条に基づく資料
の提出の猶予期間は、承認取得から起算して4ヶ月と
する。また、提出された資料等により、承認事項を変更
する必要が認められた場合には、医薬品医療機器等
法第74条の2第3項に基づき承認事項の変更を命ずる
ことがあること。
○重要な特定されたリスク
該当なし
○重要な潜在的リスク
骨髄抑制、催奇形性
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・投与に際しての患者への説明と理解の実施(同意説
明文書、患者ハンドブック)
・医療従事者向け資材(ラゲブリオ®カプセル200 mg
「妊娠している女性、妊娠している可能性のある女性、
又は妊娠する可能性のある女性」への投与に関する
お願い)の作成と提供
モルヌピラビル
SARS-CoV-2による感染症
【特例承認に係る品目】
ソムアトロゴン(遺伝子組
換え)
○重要な特定されたリスク
糖代謝障害
○重要な潜在的リスク
新生物
なお、海外において本剤は、20■■年■■
○重要な不足情報
骨端線閉鎖を伴わない成長ホルモン分泌不全性
医薬品リスク管理計画を策定の上、適切に実施するこ
月に米国、20■■年■■月に欧州で申請さ
該当なし
低身長症
と。
○追加の医薬品安全性監視活動
れ、20■■年■■月現在、審査中である。
・市販直後調査
・長期使用に関する特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
クラゾセンタンナトリウム
○重要な特定されたリスク
体液貯留(胸水、肺水腫、脳浮腫)、頭蓋内出血、催奇
形性
○重要な潜在的リスク
低血圧/血圧低下、貧血/ヘモグロビン減少、肝機能
異常、
海外において本薬は、Vangard Medica Ltd
頻脈性不整脈(QT 延長を含む上室性及び心室性不
社により■■■■年から臨床開発が開始さ
整脈)、OATP1B1/1B3を阻害する薬剤との併用
脳動脈瘤によるくも膜下出血術後の脳血管攣縮、
れ、2021年8月現在、本申請の対象となる 医薬品リスク管理計画を策定の上、適切に実施するこ
及びこれに伴う脳梗塞及び脳虚血症状の発症抑
○重要な不足情報
効能・効果について第Ⅲ相試験を実施中で と。
制
・75歳以上の高齢者における安全性
あり、いずれの国又は地域においても申請
・肝機能障害患者における安全性
又は承認されていない。
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査(長期観察)
○追加のリスク最小化活動
・市販直後調査における情報提供
・医療従事者向け資材(適正使用ガイド)の作成と提供
2
製造販売承認された医薬品の情報
(令和3年11月22日~令和4年2月18日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
3
カテゴリー
④特例承認
※2
承認日
R3.12.24
③海外承認なし R4.1.20
③海外承認なし R4.1.20
販
売
名
(製造販売業者名)
ラゲブリオカプセル200 mg
(MSD㈱)
エヌジェンラ皮下注24 mgペン
同
皮下注60 mgペン
(ファイザー㈱)
ピヴラッツ点滴静注液150 mg
(イドルシアファーマシューティカル
ズジャパン㈱)
有効成分名
海外での使用実績
※審査報告書から抜粋
効能・効果等
今般、申請者は、英国においてConditional
Marketing Authorizationが得られているこ
と、米国FDAにおいてEmergency Use
Authorizationが申請されAdvisory
Committeeにおいて許可勧告されているこ
と及び国際共同第Ⅱ/Ⅲ相試験(MK-4482002試験)の速報値等に基づき、本品目は
医薬品医療機器等法第14条の3第1項に基
づく第14条第1項の承認に該当するとして、
特例承認に係る承認申請を行った。
承認条件
医薬品リスク管理計画(主なもの)
1. 医薬品リスク管理計画を策定の上、適切に実施する
こと。
2. 本剤の投与が適切と判断される症例のみを対象に、
あらかじめ患者又は代諾者に有効性及び安全性に関
する情報が文書をもって説明され、文書による同意を
得てから初めて投与されるよう、医師に対して要請する
こと。
3. 医薬品医療機器等法施行規則第41条に基づく資料
の提出の猶予期間は、承認取得から起算して4ヶ月と
する。また、提出された資料等により、承認事項を変更
する必要が認められた場合には、医薬品医療機器等
法第74条の2第3項に基づき承認事項の変更を命ずる
ことがあること。
○重要な特定されたリスク
該当なし
○重要な潜在的リスク
骨髄抑制、催奇形性
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・投与に際しての患者への説明と理解の実施(同意説
明文書、患者ハンドブック)
・医療従事者向け資材(ラゲブリオ®カプセル200 mg
「妊娠している女性、妊娠している可能性のある女性、
又は妊娠する可能性のある女性」への投与に関する
お願い)の作成と提供
モルヌピラビル
SARS-CoV-2による感染症
【特例承認に係る品目】
ソムアトロゴン(遺伝子組
換え)
○重要な特定されたリスク
糖代謝障害
○重要な潜在的リスク
新生物
なお、海外において本剤は、20■■年■■
○重要な不足情報
骨端線閉鎖を伴わない成長ホルモン分泌不全性
医薬品リスク管理計画を策定の上、適切に実施するこ
月に米国、20■■年■■月に欧州で申請さ
該当なし
低身長症
と。
○追加の医薬品安全性監視活動
れ、20■■年■■月現在、審査中である。
・市販直後調査
・長期使用に関する特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
クラゾセンタンナトリウム
○重要な特定されたリスク
体液貯留(胸水、肺水腫、脳浮腫)、頭蓋内出血、催奇
形性
○重要な潜在的リスク
低血圧/血圧低下、貧血/ヘモグロビン減少、肝機能
異常、
海外において本薬は、Vangard Medica Ltd
頻脈性不整脈(QT 延長を含む上室性及び心室性不
社により■■■■年から臨床開発が開始さ
整脈)、OATP1B1/1B3を阻害する薬剤との併用
脳動脈瘤によるくも膜下出血術後の脳血管攣縮、
れ、2021年8月現在、本申請の対象となる 医薬品リスク管理計画を策定の上、適切に実施するこ
及びこれに伴う脳梗塞及び脳虚血症状の発症抑
○重要な不足情報
効能・効果について第Ⅲ相試験を実施中で と。
制
・75歳以上の高齢者における安全性
あり、いずれの国又は地域においても申請
・肝機能障害患者における安全性
又は承認されていない。
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査(長期観察)
○追加のリスク最小化活動
・市販直後調査における情報提供
・医療従事者向け資材(適正使用ガイド)の作成と提供
2