よむ、つかう、まなぶ。
【資料2】医薬・生活衛生局からの定期報告 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
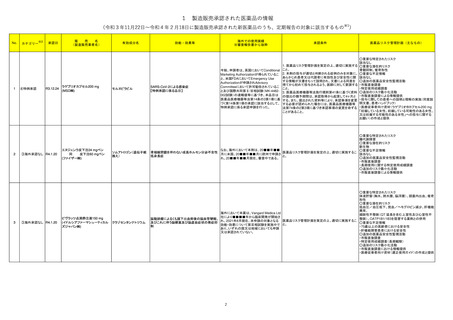
No.
4
5
6
カテゴリー
※2
承認日
③海外承認なし R4.1.20
③海外承認なし R4.1.20
④特例承認
R4.2.10
販
売
名
(製造販売業者名)
ウィフガート点滴静注400 mg
(アルジェニクスジャパン㈱)
リフヌア錠45 mg
(MSD㈱)
パキロビッドパック
(ファイザー㈱)
有効成分名
海外での使用実績
※審査報告書から抜粋
効能・効果等
承認条件
1.医薬品リスク管理計画を策定の上、適切に実施する
こと。
海外では、gMGにかかる効能に関して、米 2.国内での治験症例が極めて限られていることから、
全身型重症筋無力症(ステロイド剤又はステロイド
国では2020年12月に、欧州では2021年8月 製造販売後、一定数の症例に係るデータが集積される
エフガルチギモド アルファ 剤以外の免疫抑制剤が十分に奏効しない場合に
に承認申請が行われ、現在、審査中であ
までの間は、全症例を対象に使用成績調査を実施する
(遺伝子組換え)
限る)
る。2021年9月現在、本剤が承認されている ことにより、本剤の使用患者の背景情報を把握すると
【希少疾病用医薬品】
ともに、本剤の安全性及び有効性に関するデータを早
国又は地域はない。
期に収集し、本剤の適正使用に必要な措置を講じるこ
と。
ゲーファピキサントクエン
酸塩
ニルマトレルビル/リトナビ
ル
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
感染症、infusion reaction
○重要な潜在的リスク
該当なし
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査(長期使用)
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材の作成、提供
・患者向け情報提供資材の作成、提供
難治性の慢性咳嗽
○重要な特定されたリスク
味覚異常
○重要な潜在的リスク
本剤の臨床開発は20■■年■月より開始
尿中の結晶性異物に起因する腎障害
され、今般、日本を含む国際共同試験の成
○重要な不足情報
績等に基づき製造販売承認申請が行われ 医薬品リスク管理計画を策定の上、適切に実施するこ
該当なし
た。海外においては、2021年10月現在、米 と。
○追加の医薬品安全性監視活動
国、■■、■■及び■■において審査中で
・市販直後調査
ある。
・一般使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
SARS-CoV-2による感染症
【特例承認に係る品目】
1. 医薬品リスク管理計画を策定の上、適切に実施する
こと。
2. 本剤の投与が適切と判断される症例のみを対象に、
今般、申請者は、米国FDA による
あらかじめ患者又は代諾者に有効性及び安全性に関
Emergency Use Authorizationが得られて する情報が文書をもって説明され、文書による同意を
いること及び国際共同第Ⅱ/Ⅲ相試験
得てから初めて投与されるよう、医師に対して要請する
(C4671005試験)成績等に基づき、本品目 こと。
は医薬品医療機器等法第14条の3第1項に 3. 医薬品医療機器等法施行規則第41条に基づく資料
基づく第14条第1項の承認に該当するとし の提出の猶予期間は、承認取得から起算して7ヶ月と
する。また、提出された資料等により、承認事項を変更
て、特例承認に係る承認申請を行った。。
する必要が認められた場合には、医薬品医療機器等
法第74条の2第3項に基づき承認事項の変更を命ずる
ことがあること。
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2 「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認に対象品目
3
○重要な特定されたリスク
中毒性表皮壊死融解症,皮膚粘膜眼症候群、肝機能
障害
○重要な潜在的リスク
高血糖,糖尿病、出血傾向
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・投与に際しての患者への説明と理解の実施(同意説
明文書,患者ハンドブック)
4
5
6
カテゴリー
※2
承認日
③海外承認なし R4.1.20
③海外承認なし R4.1.20
④特例承認
R4.2.10
販
売
名
(製造販売業者名)
ウィフガート点滴静注400 mg
(アルジェニクスジャパン㈱)
リフヌア錠45 mg
(MSD㈱)
パキロビッドパック
(ファイザー㈱)
有効成分名
海外での使用実績
※審査報告書から抜粋
効能・効果等
承認条件
1.医薬品リスク管理計画を策定の上、適切に実施する
こと。
海外では、gMGにかかる効能に関して、米 2.国内での治験症例が極めて限られていることから、
全身型重症筋無力症(ステロイド剤又はステロイド
国では2020年12月に、欧州では2021年8月 製造販売後、一定数の症例に係るデータが集積される
エフガルチギモド アルファ 剤以外の免疫抑制剤が十分に奏効しない場合に
に承認申請が行われ、現在、審査中であ
までの間は、全症例を対象に使用成績調査を実施する
(遺伝子組換え)
限る)
る。2021年9月現在、本剤が承認されている ことにより、本剤の使用患者の背景情報を把握すると
【希少疾病用医薬品】
ともに、本剤の安全性及び有効性に関するデータを早
国又は地域はない。
期に収集し、本剤の適正使用に必要な措置を講じるこ
と。
ゲーファピキサントクエン
酸塩
ニルマトレルビル/リトナビ
ル
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
感染症、infusion reaction
○重要な潜在的リスク
該当なし
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査(長期使用)
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材の作成、提供
・患者向け情報提供資材の作成、提供
難治性の慢性咳嗽
○重要な特定されたリスク
味覚異常
○重要な潜在的リスク
本剤の臨床開発は20■■年■月より開始
尿中の結晶性異物に起因する腎障害
され、今般、日本を含む国際共同試験の成
○重要な不足情報
績等に基づき製造販売承認申請が行われ 医薬品リスク管理計画を策定の上、適切に実施するこ
該当なし
た。海外においては、2021年10月現在、米 と。
○追加の医薬品安全性監視活動
国、■■、■■及び■■において審査中で
・市販直後調査
ある。
・一般使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
SARS-CoV-2による感染症
【特例承認に係る品目】
1. 医薬品リスク管理計画を策定の上、適切に実施する
こと。
2. 本剤の投与が適切と判断される症例のみを対象に、
今般、申請者は、米国FDA による
あらかじめ患者又は代諾者に有効性及び安全性に関
Emergency Use Authorizationが得られて する情報が文書をもって説明され、文書による同意を
いること及び国際共同第Ⅱ/Ⅲ相試験
得てから初めて投与されるよう、医師に対して要請する
(C4671005試験)成績等に基づき、本品目 こと。
は医薬品医療機器等法第14条の3第1項に 3. 医薬品医療機器等法施行規則第41条に基づく資料
基づく第14条第1項の承認に該当するとし の提出の猶予期間は、承認取得から起算して7ヶ月と
する。また、提出された資料等により、承認事項を変更
て、特例承認に係る承認申請を行った。。
する必要が認められた場合には、医薬品医療機器等
法第74条の2第3項に基づき承認事項の変更を命ずる
ことがあること。
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2 「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認に対象品目
3
○重要な特定されたリスク
中毒性表皮壊死融解症,皮膚粘膜眼症候群、肝機能
障害
○重要な潜在的リスク
高血糖,糖尿病、出血傾向
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・投与に際しての患者への説明と理解の実施(同意説
明文書,患者ハンドブック)