よむ、つかう、まなぶ。
資料1-1 製造販売後調査の終了に伴うリスク区分の検討について[612KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39892.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和6年度第2回 4/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
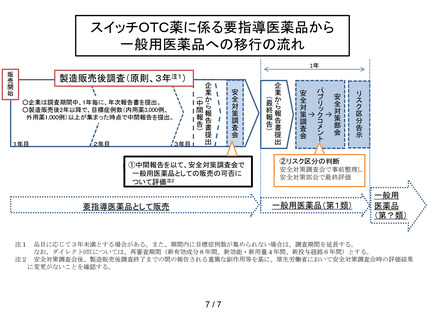
一般用医薬品のリスク区分の変更手順について
平成21年5月8日
医薬品等安全対策部会
1. 平成 21 年 6 月から薬事法に基づく、一般用医薬品の販売におけるリスク区分が実
施されることとなっている。また、医薬品等安全対策部会は、薬事法第 36 条の 3
第 3 項の規定により、一般用医薬品の区分等及びその変更に関する事項の調査審議
を行うこととされている。
2. 一般用医薬品のリスク区分等については、従前より厚生科学審議会 医薬品販売制
度改正検討部会報告書(平成17年12月25日)に従って実施されてきたところ。
(1) 評価項目として「相互作用(飲みあわせ)」、「副作用」、「患者背景(例えば、
小児、妊娠中など)」、「効能・効果(漫然と使用し続けた時に症状の悪化につ
ながるおそれ)」、
「使用方法(誤使用のおそれ)」、
「スイッチ化等に伴う使用環
境の変化」の6項目について個別の成分のリスクを評価する。
(2) 一般用医薬品に配合される主たる成分について、各成分のリスクの評価をもと
に、「スイッチOTCの市販後調査(PMS)期間中又は PMS 終了後引き続き
副作用等の発現に注意を要するもの」に相当する成分を第1類に、
「相互作用」、
「副作用」及び「患者背景」のいずれかの項目でリスクの高い成分を第2類に、
それ以外を第3類に機械的に振り分ける。
(3) 機械的な振り分けの結果の妥当性について、専門的な知識・経験をもとに個々
の成分毎にさらに検討を加え評価する。
3. 医薬品等安全対策部会において、医療用医薬品の使用上の注意の変更に伴うリスク
区分の変更、スイッチOTC等の市販後調査の終了に伴うリスク区分の変更等の調
査・審議を継続して行うこととなるが、これらの変更手続きにおいて、今後、諮問
を行った後、医薬品等安全対策部会長の了解を得て、次のように調査審議事項の事
前整理等を「安全対策調査会」に行わせることとする。
(1) 安全対策調査会の調査審議に当たり、必要に応じ、関係学会等の有識者等の出
席を求め、意見を聴取し、事前整理を行い、その結果、リスク区分等の変更を
行う必要があるとされた場合、厚生労働省は、変更案についてパブリックコメ
ントを行う。
(2) 厚生労働省は、医薬品等安全対策部会を開催し、安全対策調査会における事前
整理の結果、パブリックコメントの結果等について調査審議を行い、指定の変
更の要否について答申を得る。
2/7
平成21年5月8日
医薬品等安全対策部会
1. 平成 21 年 6 月から薬事法に基づく、一般用医薬品の販売におけるリスク区分が実
施されることとなっている。また、医薬品等安全対策部会は、薬事法第 36 条の 3
第 3 項の規定により、一般用医薬品の区分等及びその変更に関する事項の調査審議
を行うこととされている。
2. 一般用医薬品のリスク区分等については、従前より厚生科学審議会 医薬品販売制
度改正検討部会報告書(平成17年12月25日)に従って実施されてきたところ。
(1) 評価項目として「相互作用(飲みあわせ)」、「副作用」、「患者背景(例えば、
小児、妊娠中など)」、「効能・効果(漫然と使用し続けた時に症状の悪化につ
ながるおそれ)」、
「使用方法(誤使用のおそれ)」、
「スイッチ化等に伴う使用環
境の変化」の6項目について個別の成分のリスクを評価する。
(2) 一般用医薬品に配合される主たる成分について、各成分のリスクの評価をもと
に、「スイッチOTCの市販後調査(PMS)期間中又は PMS 終了後引き続き
副作用等の発現に注意を要するもの」に相当する成分を第1類に、
「相互作用」、
「副作用」及び「患者背景」のいずれかの項目でリスクの高い成分を第2類に、
それ以外を第3類に機械的に振り分ける。
(3) 機械的な振り分けの結果の妥当性について、専門的な知識・経験をもとに個々
の成分毎にさらに検討を加え評価する。
3. 医薬品等安全対策部会において、医療用医薬品の使用上の注意の変更に伴うリスク
区分の変更、スイッチOTC等の市販後調査の終了に伴うリスク区分の変更等の調
査・審議を継続して行うこととなるが、これらの変更手続きにおいて、今後、諮問
を行った後、医薬品等安全対策部会長の了解を得て、次のように調査審議事項の事
前整理等を「安全対策調査会」に行わせることとする。
(1) 安全対策調査会の調査審議に当たり、必要に応じ、関係学会等の有識者等の出
席を求め、意見を聴取し、事前整理を行い、その結果、リスク区分等の変更を
行う必要があるとされた場合、厚生労働省は、変更案についてパブリックコメ
ントを行う。
(2) 厚生労働省は、医薬品等安全対策部会を開催し、安全対策調査会における事前
整理の結果、パブリックコメントの結果等について調査審議を行い、指定の変
更の要否について答申を得る。
2/7