よむ、つかう、まなぶ。
資 料 2-2 供血者からの遡及調査の進捗状況等について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40647.html |
| 出典情報 | 薬事審議会 血液事業部会運営委員会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙
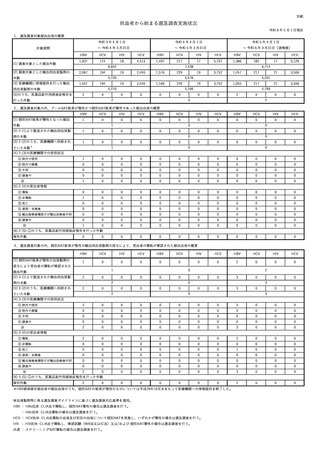
供血者から始まる遡及調査実施状況
令和6年5月1日現在
1.遡及調査対象献血血液の概要
対象期間
(1) 調査対象とした献血件数
(2) 調査対象とした輸血用血液製剤の
令和3年4月1日
令和4年4月1日
令和5年4月1日
~ 令和4年3月31日
~ 令和5年3月31日
~ 令和6年3月31日(速報値)
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
1,937
174
18
4,513
1,497
217
17
5,707
1,386
182
17
5,129
2,067
194
19
2,440
1,576
229
19
3,752
1,457
217
21
3,506
21
3,506
0
0
6,642
7,438
4,720
本数
(3) 医療機関に情報提供を行った輸血
1,557
194
(3)のうち、医薬品副作用感染症報告を
5,576
19
2,440
1,166
229
4,210
用血液製剤の本数
2
0
5,201
19
3,752
1,055
217
5,166
0
0
0
0
2
行った件数
6,714
4,799
0
0
2
0
0
2
2.遡及調査対象の内、プールNAT結果が陰性かつ個別NAT結果が陽性であった献血血液の概要
(1) 個別NAT結果が陽性となった献血
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
1
件数
(2) 2-(1)より製造された輸血用血液製
剤の本数
(3) 2-(2)のうち、医療機関へ供給され
1
0
0
0
0
0
0
1
1
0
ていた本数*
(4) 2-(3)の医療機関での使用状況
0
0
0
0
0
0
0
0
0
0
1
0
0
0
0
0
0
0
① 院内で使用
1
0
0
0
0
0
0
0
0
0
0
0
② 院内で廃棄
0
0
0
0
0
0
0
0
0
0
0
0
③ 不明
0
0
0
0
0
0
0
0
0
0
0
0
④ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
1
0
0
0
0
0
0
0
0
0
0
0
① 陽転
0
0
0
0
0
0
0
0
0
0
0
0
② 非陽転
1
0
0
0
0
0
0
0
0
0
0
0
③ 死亡
0
0
0
0
0
0
0
0
0
0
0
0
④ 退院・未検査
0
0
0
0
0
0
0
0
0
0
0
0
⑤ 輸血後検査陽性だが輸血前検査不明
0
0
0
0
0
0
0
0
0
0
0
0
⑥ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
(5) 2-(4)の受血者情報
(6) 2-(5)-①のうち、医薬品副作用感染症報告を行った件数
報告件数
0
0
3.遡及調査対象の内、個別NAT結果が陰性の輸血用血液製剤の投与により、受血者の陽転が確認された献血血液の概要
(1) 個別NAT結果が陰性の血液製剤の
投与により受血者の陽転が確認された
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
1
0
0
0
0
0
0
0
2
0
0
0
2
0
0
0
0
0
0
0
3
0
0
0
0
0
1
献血件数
(2) 3-(1)より製造された輸血用血液製
2
剤の本数
(3) 3-(2)のうち、医療機関へ供給され
0
2
0
0
0
0
0
0
2
ていた本数
2
3
0
0
3
0
0
3
(4) 3-(3)の医療機関での使用状況
① 院内で使用
2
0
0
0
0
0
0
0
3
0
0
0
② 院内で廃棄
0
0
0
0
0
0
0
0
0
0
0
0
③ 不明
0
0
0
0
0
0
0
0
0
0
0
0
④ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
2
0
0
0
0
0
0
0
3
0
0
0
① 陽転
2
0
0
0
0
0
0
0
2
0
0
0
② 非陽転
0
0
0
0
0
0
0
0
0
0
0
0
③ 死亡
0
0
0
0
0
0
0
0
1
0
0
0
④ 退院・未検査
0
0
0
0
0
0
0
0
0
0
0
0
⑤ 輸血後検査陽性だが輸血前検査不明
0
0
0
0
0
0
0
0
0
0
0
0
⑥ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
2
0
0
0
0
0
0
0
3
0
0
0
0
0
0
0
0
0
2
0
0
0
(5) 3-(4)の受血者情報
(6) 3-(5)-①のうち、医薬品副作用感染症報告を行った件数
報告件数
2
0
*HBV感染既往献血者の献血血液のうち、個別NATの結果が陰性のものについては平成29年10月末をもって医療機関への情報提供を終了した。
※血液製剤等に係る遡及調査ガイドラインに基づく遡及調査対応基準を適用。
HBV : HBs抗原 CLIA法で陽転し、個別NAT陽性の場合は遡及調査を行う。
: HBc抗体 CLIA法陽転の場合は遡及調査を行う。
HCV : HCV抗体 CLIA法陽転の血液及び前回の血液について個別NATを実施し、いずれかが陽性の場合は遡及調査を行う。
HIV : HIV抗体 CLIA法で陽転し、確認試験(WB法又はIC法)又は/および 個別NAT陽性の場合は遡及調査を行う。
共通 : スクリーニングNAT陽転の場合は遡及調査を行う。
1
供血者から始まる遡及調査実施状況
令和6年5月1日現在
1.遡及調査対象献血血液の概要
対象期間
(1) 調査対象とした献血件数
(2) 調査対象とした輸血用血液製剤の
令和3年4月1日
令和4年4月1日
令和5年4月1日
~ 令和4年3月31日
~ 令和5年3月31日
~ 令和6年3月31日(速報値)
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
1,937
174
18
4,513
1,497
217
17
5,707
1,386
182
17
5,129
2,067
194
19
2,440
1,576
229
19
3,752
1,457
217
21
3,506
21
3,506
0
0
6,642
7,438
4,720
本数
(3) 医療機関に情報提供を行った輸血
1,557
194
(3)のうち、医薬品副作用感染症報告を
5,576
19
2,440
1,166
229
4,210
用血液製剤の本数
2
0
5,201
19
3,752
1,055
217
5,166
0
0
0
0
2
行った件数
6,714
4,799
0
0
2
0
0
2
2.遡及調査対象の内、プールNAT結果が陰性かつ個別NAT結果が陽性であった献血血液の概要
(1) 個別NAT結果が陽性となった献血
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
1
件数
(2) 2-(1)より製造された輸血用血液製
剤の本数
(3) 2-(2)のうち、医療機関へ供給され
1
0
0
0
0
0
0
1
1
0
ていた本数*
(4) 2-(3)の医療機関での使用状況
0
0
0
0
0
0
0
0
0
0
1
0
0
0
0
0
0
0
① 院内で使用
1
0
0
0
0
0
0
0
0
0
0
0
② 院内で廃棄
0
0
0
0
0
0
0
0
0
0
0
0
③ 不明
0
0
0
0
0
0
0
0
0
0
0
0
④ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
1
0
0
0
0
0
0
0
0
0
0
0
① 陽転
0
0
0
0
0
0
0
0
0
0
0
0
② 非陽転
1
0
0
0
0
0
0
0
0
0
0
0
③ 死亡
0
0
0
0
0
0
0
0
0
0
0
0
④ 退院・未検査
0
0
0
0
0
0
0
0
0
0
0
0
⑤ 輸血後検査陽性だが輸血前検査不明
0
0
0
0
0
0
0
0
0
0
0
0
⑥ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
(5) 2-(4)の受血者情報
(6) 2-(5)-①のうち、医薬品副作用感染症報告を行った件数
報告件数
0
0
3.遡及調査対象の内、個別NAT結果が陰性の輸血用血液製剤の投与により、受血者の陽転が確認された献血血液の概要
(1) 個別NAT結果が陰性の血液製剤の
投与により受血者の陽転が確認された
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
HBV
HCV
HIV
HEV
1
0
0
0
0
0
0
0
2
0
0
0
2
0
0
0
0
0
0
0
3
0
0
0
0
0
1
献血件数
(2) 3-(1)より製造された輸血用血液製
2
剤の本数
(3) 3-(2)のうち、医療機関へ供給され
0
2
0
0
0
0
0
0
2
ていた本数
2
3
0
0
3
0
0
3
(4) 3-(3)の医療機関での使用状況
① 院内で使用
2
0
0
0
0
0
0
0
3
0
0
0
② 院内で廃棄
0
0
0
0
0
0
0
0
0
0
0
0
③ 不明
0
0
0
0
0
0
0
0
0
0
0
0
④ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
2
0
0
0
0
0
0
0
3
0
0
0
① 陽転
2
0
0
0
0
0
0
0
2
0
0
0
② 非陽転
0
0
0
0
0
0
0
0
0
0
0
0
③ 死亡
0
0
0
0
0
0
0
0
1
0
0
0
④ 退院・未検査
0
0
0
0
0
0
0
0
0
0
0
0
⑤ 輸血後検査陽性だが輸血前検査不明
0
0
0
0
0
0
0
0
0
0
0
0
⑥ 調査中
0
0
0
0
0
0
0
0
0
0
0
0
計
2
0
0
0
0
0
0
0
3
0
0
0
0
0
0
0
0
0
2
0
0
0
(5) 3-(4)の受血者情報
(6) 3-(5)-①のうち、医薬品副作用感染症報告を行った件数
報告件数
2
0
*HBV感染既往献血者の献血血液のうち、個別NATの結果が陰性のものについては平成29年10月末をもって医療機関への情報提供を終了した。
※血液製剤等に係る遡及調査ガイドラインに基づく遡及調査対応基準を適用。
HBV : HBs抗原 CLIA法で陽転し、個別NAT陽性の場合は遡及調査を行う。
: HBc抗体 CLIA法陽転の場合は遡及調査を行う。
HCV : HCV抗体 CLIA法陽転の血液及び前回の血液について個別NATを実施し、いずれかが陽性の場合は遡及調査を行う。
HIV : HIV抗体 CLIA法で陽転し、確認試験(WB法又はIC法)又は/および 個別NAT陽性の場合は遡及調査を行う。
共通 : スクリーニングNAT陽転の場合は遡及調査を行う。
1