よむ、つかう、まなぶ。
議題1 参考資料1患者申出療養の総括報告書に関する評価について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40866.html |
| 出典情報 | 患者申出療養評価会議(第51回 6/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
日本における
薬事承認状況
効能・効果
・BRAF遺伝子変異を有する
悪性黒色腫
・BRAF遺伝子変異を有する
切除不能な進行・再発の非
小細胞肺癌
承認年月(2剤併用として)
2016年3月
米国・欧州における
薬事承認状況
効能・効果
・BRAFV600E/K遺伝子変
異を有する切除不能または
転移性悪性黒色腫
・BRAFV600E/K遺伝子変
異を有するリンパ節転移の
ある悪性黒色腫への術後治
療
・BRAFV600E遺伝子変異を
有する非小細胞肺癌
・BRAFV600E変異を有する
局所進行または転移性未分
化甲状腺癌(米国)
承認年月(2剤併用として)
2014年1月(米国)
2015年9月(欧州)
薬事承認までのロードマップ
BRAFV600変異陽性の低悪性度神経膠腫(LGG)、若しくは再発又
は難治性高悪性度神経膠腫(HGG)を有する小児及び青少年患者
を対象にトラメチニブとの併用によるダブラフェニブの効果を評価 有用性が
認められた場合
する第Ⅱ相、非盲検、国際共同試験
対象: BRAFV600変異陽性の低悪性度神経膠腫(LGG)、若しくは再発又は難治性高
悪性度神経膠腫(HGG)を有する小児及び青少年患者
デザイン:非盲検, LGG 2:1の比率で治験薬群と化学療法群に無作為割付, HGG 単群
登録症例数:LGG 102名、HCG 40名 (日本人 13名)
参考
試験期間:2017年12月~2025年10月(登録期間 終了)
データ
適応追加
医療としての
有用性が認め
られなかった
場合
開発中止
【患者申出療養】
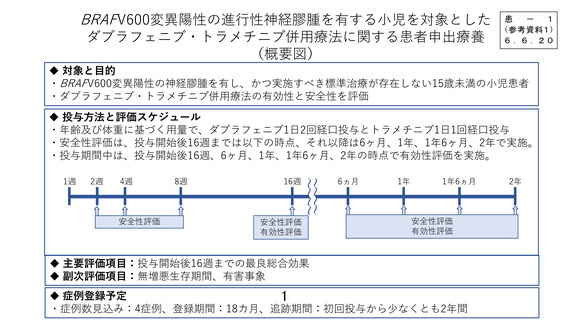
BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした
ダブラフェニブ・トラメチニブ併用療法に関する患者申出療養
対象:BRAFV600変異陽性の神経膠腫を有し、かつ実施すべき標準治療が存在しない15歳未満の小児
目的:ダブラフェニブ・トラメチニブ併用療法の有効性と安全性を評価
評価項目:投与開始後16週までの最良総合効果、無増悪生存期間、有害事象
症例数見込み:4症例
予定期間:登録期間 18か月 追跡期間:初回投与から少なくとも2年間
実施医療機関:九州大学病院
安全性上の問題等で、継続が不適切と
考えられた場合
患者申出療養の取り下げ
2
薬事承認状況
効能・効果
・BRAF遺伝子変異を有する
悪性黒色腫
・BRAF遺伝子変異を有する
切除不能な進行・再発の非
小細胞肺癌
承認年月(2剤併用として)
2016年3月
米国・欧州における
薬事承認状況
効能・効果
・BRAFV600E/K遺伝子変
異を有する切除不能または
転移性悪性黒色腫
・BRAFV600E/K遺伝子変
異を有するリンパ節転移の
ある悪性黒色腫への術後治
療
・BRAFV600E遺伝子変異を
有する非小細胞肺癌
・BRAFV600E変異を有する
局所進行または転移性未分
化甲状腺癌(米国)
承認年月(2剤併用として)
2014年1月(米国)
2015年9月(欧州)
薬事承認までのロードマップ
BRAFV600変異陽性の低悪性度神経膠腫(LGG)、若しくは再発又
は難治性高悪性度神経膠腫(HGG)を有する小児及び青少年患者
を対象にトラメチニブとの併用によるダブラフェニブの効果を評価 有用性が
認められた場合
する第Ⅱ相、非盲検、国際共同試験
対象: BRAFV600変異陽性の低悪性度神経膠腫(LGG)、若しくは再発又は難治性高
悪性度神経膠腫(HGG)を有する小児及び青少年患者
デザイン:非盲検, LGG 2:1の比率で治験薬群と化学療法群に無作為割付, HGG 単群
登録症例数:LGG 102名、HCG 40名 (日本人 13名)
参考
試験期間:2017年12月~2025年10月(登録期間 終了)
データ
適応追加
医療としての
有用性が認め
られなかった
場合
開発中止
【患者申出療養】
BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした
ダブラフェニブ・トラメチニブ併用療法に関する患者申出療養
対象:BRAFV600変異陽性の神経膠腫を有し、かつ実施すべき標準治療が存在しない15歳未満の小児
目的:ダブラフェニブ・トラメチニブ併用療法の有効性と安全性を評価
評価項目:投与開始後16週までの最良総合効果、無増悪生存期間、有害事象
症例数見込み:4症例
予定期間:登録期間 18か月 追跡期間:初回投与から少なくとも2年間
実施医療機関:九州大学病院
安全性上の問題等で、継続が不適切と
考えられた場合
患者申出療養の取り下げ
2