よむ、つかう、まなぶ。
資料5-1 申請医療機関からの報告(国立循環器病研究センター)について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43105.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第165回 9/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
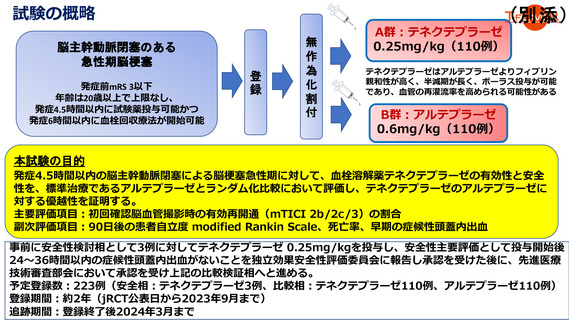
試験の概略
脳主幹動脈閉塞のある
急性期脳梗塞
発症前mRS 3以下
年齢は20歳以上で上限なし、
発症4.5時間以内に試験薬投与可能かつ
発症6時間以内に血栓回収療法が開始可能
登
録
無
作
為
化
割
付
A群:テネクテプラーゼ
0.25mg/kg(110例)
(別添)
テネクテプラーゼはアルテプラーゼよりフィブリン
親和性が高く、半減期が長く、ボーラス投与が可能
であり、血管の再灌流率を高められる可能性がある
B群:アルテプラーゼ
0.6mg/kg(110例)
本試験の目的
発症4.5時間以内の脳主幹動脈閉塞による脳梗塞急性期に対して、血栓溶解薬テネクテプラーゼの有効性と安全
性を、標準治療であるアルテプラーゼとランダム化比較において評価し、テネクテプラーゼのアルテプラーゼに
対する優越性を証明する。
主要評価項目:初回確認脳血管撮影時の有効再開通(mTICI 2b/2c /3)の割合
副次評価項目:90日後の患者自立度 modified Rankin Scale、死亡率、早期の症候性頭蓋内出血
事前に安全性検討相として3例に対してテネクテプラーゼ 0.25mg/kgを投与し、安全性主要評価として投与開始後
24~36時間以内の症候性頭蓋内出血がないことを独立効果安全性評価委員会に報告し承認を受けた後に、先進医療
技術審査部会において承認を受け上記の比較検証相へと進める。
予定登録数:223例(安全相:テネクテプラーゼ3例、比較相:テネクテプラーゼ110例、アルテプラーゼ110例)
登録期間:約2年(jRCT公表日から2023年9月まで)
追跡期間:登録終了後2024年3月まで
脳主幹動脈閉塞のある
急性期脳梗塞
発症前mRS 3以下
年齢は20歳以上で上限なし、
発症4.5時間以内に試験薬投与可能かつ
発症6時間以内に血栓回収療法が開始可能
登
録
無
作
為
化
割
付
A群:テネクテプラーゼ
0.25mg/kg(110例)
(別添)
テネクテプラーゼはアルテプラーゼよりフィブリン
親和性が高く、半減期が長く、ボーラス投与が可能
であり、血管の再灌流率を高められる可能性がある
B群:アルテプラーゼ
0.6mg/kg(110例)
本試験の目的
発症4.5時間以内の脳主幹動脈閉塞による脳梗塞急性期に対して、血栓溶解薬テネクテプラーゼの有効性と安全
性を、標準治療であるアルテプラーゼとランダム化比較において評価し、テネクテプラーゼのアルテプラーゼに
対する優越性を証明する。
主要評価項目:初回確認脳血管撮影時の有効再開通(mTICI 2b/2c /3)の割合
副次評価項目:90日後の患者自立度 modified Rankin Scale、死亡率、早期の症候性頭蓋内出血
事前に安全性検討相として3例に対してテネクテプラーゼ 0.25mg/kgを投与し、安全性主要評価として投与開始後
24~36時間以内の症候性頭蓋内出血がないことを独立効果安全性評価委員会に報告し承認を受けた後に、先進医療
技術審査部会において承認を受け上記の比較検証相へと進める。
予定登録数:223例(安全相:テネクテプラーゼ3例、比較相:テネクテプラーゼ110例、アルテプラーゼ110例)
登録期間:約2年(jRCT公表日から2023年9月まで)
追跡期間:登録終了後2024年3月まで