よむ、つかう、まなぶ。
資料1 感染症対策上の必要性の高い医薬品の承認申請について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43979.html |
| 出典情報 | 厚生科学審議会 危機対応医薬品等に関する小委員会(第5回 9/30)・重点感染症作業班(第1回 9/30)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
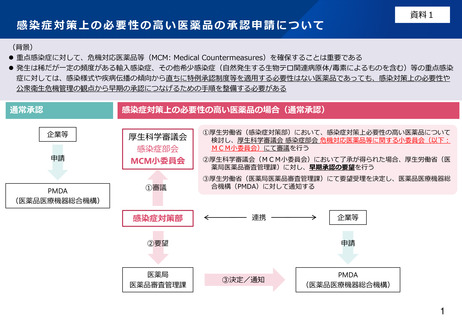
(参考)・感染症対策上の必要性の高い医薬品に該当する医薬品の条件
・医薬品の承認申請、審査及び調査において留意される点
該当する医薬品(いずれの条件も満たす品目)
1. 重点感染症に対する医薬品その他の感染症対策上の必要性の高い医薬品であること
2. 国内で発生が極めて少なくまれ又は発生していない等の理由で、国内の医療環境下における患者を対象とした有効性に関する比
較試験臨床試験の実施が困難であること
3. その用途に関し、外国(本邦と同等の水準にあると認められる承認の制度又はこれに相当する制度を有している国をいう。)に
おいて、販売し、授与し、又は販売若しくは授与の目的で貯蔵し、若しくは陳列することが認められている医薬品であること
4. 申請者が、外国の承認申請において提出した資料(CTD第2部~第5部相当資料)を提出することが可能であること
医薬品の承認申請、審査及び調査において留意される点
1. 審査及び調査の実施に当たり、外国の承認申請において提出された資料に基づき、当該申請資料に係る説明内容を踏まえて審査
及び調査を行うこと。
2. 審査及び調査の実施に当たり、一部の試験結果については、提出を求めない又は承認後の提出とすることで差し支えないこと。
例えば、外国において、患者を対象とした有効性及び安全性に係るデータ提出を求められず、動物試験成績のみで承認され、そ
の後も新たなデータが得られていない場合、患者を対象とした試験成績を提出する必要はないこと。
3. 申請者は、外国承認後から本邦における承認申請までの間に、海外で得られた使用成績や公表文献に関して十分に情報収集を行
い、日本人における有効性及び安全性の評価に必要な説明とともに適切に申請資料に反映すること。なお、CTDの構成は通常の
医療用医薬品の構成に準拠し、第1部及び第2部は日本語にて作成すること。
2
・医薬品の承認申請、審査及び調査において留意される点
該当する医薬品(いずれの条件も満たす品目)
1. 重点感染症に対する医薬品その他の感染症対策上の必要性の高い医薬品であること
2. 国内で発生が極めて少なくまれ又は発生していない等の理由で、国内の医療環境下における患者を対象とした有効性に関する比
較試験臨床試験の実施が困難であること
3. その用途に関し、外国(本邦と同等の水準にあると認められる承認の制度又はこれに相当する制度を有している国をいう。)に
おいて、販売し、授与し、又は販売若しくは授与の目的で貯蔵し、若しくは陳列することが認められている医薬品であること
4. 申請者が、外国の承認申請において提出した資料(CTD第2部~第5部相当資料)を提出することが可能であること
医薬品の承認申請、審査及び調査において留意される点
1. 審査及び調査の実施に当たり、外国の承認申請において提出された資料に基づき、当該申請資料に係る説明内容を踏まえて審査
及び調査を行うこと。
2. 審査及び調査の実施に当たり、一部の試験結果については、提出を求めない又は承認後の提出とすることで差し支えないこと。
例えば、外国において、患者を対象とした有効性及び安全性に係るデータ提出を求められず、動物試験成績のみで承認され、そ
の後も新たなデータが得られていない場合、患者を対象とした試験成績を提出する必要はないこと。
3. 申請者は、外国承認後から本邦における承認申請までの間に、海外で得られた使用成績や公表文献に関して十分に情報収集を行
い、日本人における有効性及び安全性の評価に必要な説明とともに適切に申請資料に反映すること。なお、CTDの構成は通常の
医療用医薬品の構成に準拠し、第1部及び第2部は日本語にて作成すること。
2