よむ、つかう、まなぶ。
資料3:臨床研究法省令改正について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第36回
研究全体の責任主体の概念について
•
•
•
•
•
•
•
•
臨床研究部会
令和6年9月4日
資料2-3
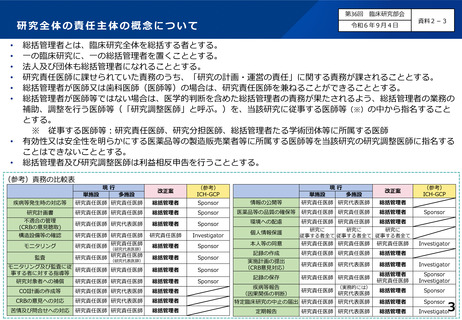
総括管理者とは、臨床研究全体を総括する者とする。
一の臨床研究に、一の総括管理者を置くこととする。
法人及び団体も総括管理者になれることとする。
研究責任医師に課せられていた責務のうち、「研究の計画・運営の責任」に関する責務が課されることとする。
総括管理者が医師又は歯科医師(医師等)の場合は、研究責任医師を兼ねることができることとする。
総括管理者が医師等ではない場合は、医学的判断を含めた総括管理者の責務が果たされるよう、総括管理者の業務の
補助、調整を行う医師等(「研究調整医師」と呼ぶ。)を、当該研究に従事する医師等(※)の中から指名すること
とする。
※ 従事する医師等:研究責任医師、研究分担医師、総括管理者たる学術団体等に所属する医師
有効性又は安全性を明らかにする医薬品等の製造販売業者等に所属する医師等を当該研究の研究調整医師に指名する
ことはできないこととする。
総括管理者及び研究調整医師は利益相反申告を行うこととする。
(参考)責務の比較表
現行
単施設
多施設
改正案
(参考)
ICH-GCP
現行
単施設
多施設
改正案
疾病等発生時の対応等
研究責任医師 研究責任医師
総括管理者
Sponsor
情報の公開等
研究責任医師 研究代表医師
総括管理者
(参考)
ICH-GCP
研究計画書
研究責任医師 研究責任医師
総括管理者
Sponsor
医薬品等の品質の確保等
研究責任医師 研究責任医師
総括管理者
不適合の管理
(CRBの意見聴取)
研究責任医師 研究代表医師
総括管理者
Sponsor
環境への配慮
研究責任医師 研究責任医師
総括管理者
構造設備等の確認
研究責任医師 研究責任医師
研究責任医師
Investigator
個人情報保護
研究に
研究に
研究に
従事する者全て 従事する者全て 従事する者全て
モニタリング
研究責任医師 研究責任医師
総括管理者
Sponsor
本人等の同意
研究責任医師 研究責任医師
研究責任医師
監査
研究責任医師 研究責任医師
総括管理者
Sponsor
記録の作成
研究責任医師 研究責任医師
総括管理者
モニタリング及び監査に従
研究責任医師 研究責任医師
事する者に対する指導等
総括管理者
Sponsor
実施計画の提出
(CRB意見対応)
研究責任医師 研究代表医師
総括管理者
Investigator
Sponsor
記録の保存
研究責任医師 研究責任医師
総括管理者
研究責任医師
Sponsor
Investigator
総括管理者
Sponsor
総括管理者
Sponsor
総括管理者
Investigator
(研究代表医師)
(研究代表医師)
研究対象者への補償
研究責任医師 研究責任医師
総括管理者
COI計画の作成等
研究責任医師 研究代表医師
総括管理者
CRBの意見への対応
研究責任医師 研究代表医師
総括管理者
苦情及び問合せへの対応
研究責任医師 研究責任医師
総括管理者
疾病等報告
(因果関係の判断)
研究責任医師
(実務的には)
研究代表医師
特定臨床研究の中止の届出 研究責任医師 研究代表医師
定期報告
研究責任医師 研究代表医師
Sponsor
Investigator
3
研究全体の責任主体の概念について
•
•
•
•
•
•
•
•
臨床研究部会
令和6年9月4日
資料2-3
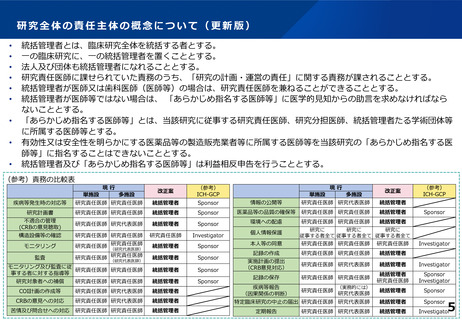
総括管理者とは、臨床研究全体を総括する者とする。
一の臨床研究に、一の総括管理者を置くこととする。
法人及び団体も総括管理者になれることとする。
研究責任医師に課せられていた責務のうち、「研究の計画・運営の責任」に関する責務が課されることとする。
総括管理者が医師又は歯科医師(医師等)の場合は、研究責任医師を兼ねることができることとする。
総括管理者が医師等ではない場合は、医学的判断を含めた総括管理者の責務が果たされるよう、総括管理者の業務の
補助、調整を行う医師等(「研究調整医師」と呼ぶ。)を、当該研究に従事する医師等(※)の中から指名すること
とする。
※ 従事する医師等:研究責任医師、研究分担医師、総括管理者たる学術団体等に所属する医師
有効性又は安全性を明らかにする医薬品等の製造販売業者等に所属する医師等を当該研究の研究調整医師に指名する
ことはできないこととする。
総括管理者及び研究調整医師は利益相反申告を行うこととする。
(参考)責務の比較表
現行
単施設
多施設
改正案
(参考)
ICH-GCP
現行
単施設
多施設
改正案
疾病等発生時の対応等
研究責任医師 研究責任医師
総括管理者
Sponsor
情報の公開等
研究責任医師 研究代表医師
総括管理者
(参考)
ICH-GCP
研究計画書
研究責任医師 研究責任医師
総括管理者
Sponsor
医薬品等の品質の確保等
研究責任医師 研究責任医師
総括管理者
不適合の管理
(CRBの意見聴取)
研究責任医師 研究代表医師
総括管理者
Sponsor
環境への配慮
研究責任医師 研究責任医師
総括管理者
構造設備等の確認
研究責任医師 研究責任医師
研究責任医師
Investigator
個人情報保護
研究に
研究に
研究に
従事する者全て 従事する者全て 従事する者全て
モニタリング
研究責任医師 研究責任医師
総括管理者
Sponsor
本人等の同意
研究責任医師 研究責任医師
研究責任医師
監査
研究責任医師 研究責任医師
総括管理者
Sponsor
記録の作成
研究責任医師 研究責任医師
総括管理者
モニタリング及び監査に従
研究責任医師 研究責任医師
事する者に対する指導等
総括管理者
Sponsor
実施計画の提出
(CRB意見対応)
研究責任医師 研究代表医師
総括管理者
Investigator
Sponsor
記録の保存
研究責任医師 研究責任医師
総括管理者
研究責任医師
Sponsor
Investigator
総括管理者
Sponsor
総括管理者
Sponsor
総括管理者
Investigator
(研究代表医師)
(研究代表医師)
研究対象者への補償
研究責任医師 研究責任医師
総括管理者
COI計画の作成等
研究責任医師 研究代表医師
総括管理者
CRBの意見への対応
研究責任医師 研究代表医師
総括管理者
苦情及び問合せへの対応
研究責任医師 研究責任医師
総括管理者
疾病等報告
(因果関係の判断)
研究責任医師
(実務的には)
研究代表医師
特定臨床研究の中止の届出 研究責任医師 研究代表医師
定期報告
研究責任医師 研究代表医師
Sponsor
Investigator
3