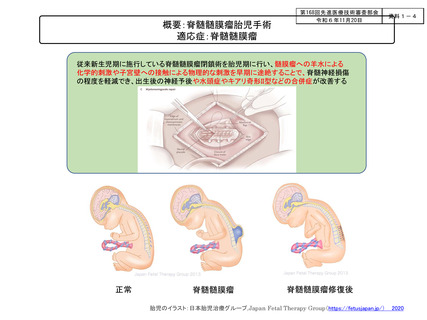
よむ、つかう、まなぶ。
資料1-4 申請技術の概要及びロードマップ (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44996.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第168回 11/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
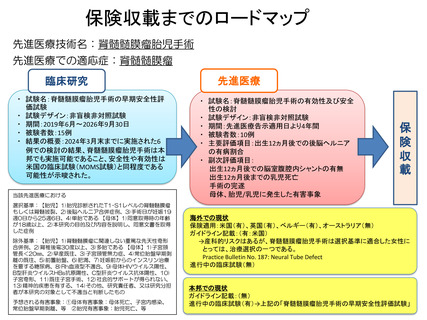
保険収載までのロードマップ
先進医療技術名:脊髄髄膜瘤胎児手術
先進医療での適応症:脊髄髄膜瘤
臨床研究
・ 試験名:脊髄髄膜瘤胎児手術の早期安全性評
価試験
・ 試験デザイン:非盲検非対照試験
・ 期間:2019年6月~2026年9月30日
・ 被験者数:15例
・ 結果の概要:2024年3月末までに実施された6
例での検討の結果、脊髄髄膜瘤胎児手術は本
邦でも実施可能であること、安全性や有効性は
米国の臨床試験(MOMS試験)と同程度である
可能性が示唆された。
当該先進医療における
選択基準:【胎児】1)胎児診断されたT1-S1レベルの脊髄髄膜瘤
もしくは脊髄披裂、2)後脳ヘルニア合併症例、3)手術日が妊娠19
週0日から25週6日、4)単胎である 【母体】1)同意取得時の年齢
が18歳以上、2)本研究の目的及び内容を説明し、同意文書を取得
した症例
除外基準:【胎児】1)脊髄髄膜瘤に関連しない重篤な先天性奇形
合併例、2)脊椎後弯30度以上、3)多胎である 【母体】1)子宮頸
管長<20㎜、2)早産既往、3)子宮頸管無力症、4)常位胎盤早期剥
離の既往、5)前置胎盤、6)肥満、7)妊娠前からのインスリン治療
を要する糖尿病、8)Rh血液型不適合、9)母体HIVウイルス陽性、
B型肝炎ウイルスHBs抗原陽性、C型肝炎ウイルス抗体陽性、10)
子宮奇形、11)既往子宮手術、12)社会的サポートが得られない、
13)精神的疾患を有する、14)その他、研究責任者、又は研究分担
者が本研究の対象として不適当と判断したもの
予想される有害事象:①母体有害事象:母体死亡、子宮内感染、
常位胎盤早期剥離、等 ②胎児有害事象:胎児死亡、等
先進医療
・ 試験名:脊髄髄膜瘤胎児手術の有効性及び安全
性の検討
・ 試験デザイン:非盲検非対照試験
・ 期間:先進医療告示適用日より4年間
・ 被験者数:10例
・ 主要評価項目:出生12ヵ月後での後脳ヘルニア
の有病割合
・ 副次評価項目:
出生12ヵ月後での脳室腹腔内シャントの有無
出生12ヵ月後までの乳児死亡
手術の完遂
母体、胎児/乳児に発生した有害事象
保
険
収
載
海外での現状
保険適用:米国(有)、英国(有)、ベルギー(有)、オーストラリア(無)
ガイドライン記載:(有:米国)
→産科的リスクはあるが、脊髄髄膜瘤胎児手術は選択基準に適合した女性に
とっては、治療選択の一つである。
Practice Bulletin No. 187: Neural Tube Defect
進行中の臨床試験(無)
本邦での現状
ガイドライン記載:(無)
進行中の臨床試験(有)→上記の「脊髄髄膜瘤胎児手術の早期安全性評価試験」
先進医療技術名:脊髄髄膜瘤胎児手術
先進医療での適応症:脊髄髄膜瘤
臨床研究
・ 試験名:脊髄髄膜瘤胎児手術の早期安全性評
価試験
・ 試験デザイン:非盲検非対照試験
・ 期間:2019年6月~2026年9月30日
・ 被験者数:15例
・ 結果の概要:2024年3月末までに実施された6
例での検討の結果、脊髄髄膜瘤胎児手術は本
邦でも実施可能であること、安全性や有効性は
米国の臨床試験(MOMS試験)と同程度である
可能性が示唆された。
当該先進医療における
選択基準:【胎児】1)胎児診断されたT1-S1レベルの脊髄髄膜瘤
もしくは脊髄披裂、2)後脳ヘルニア合併症例、3)手術日が妊娠19
週0日から25週6日、4)単胎である 【母体】1)同意取得時の年齢
が18歳以上、2)本研究の目的及び内容を説明し、同意文書を取得
した症例
除外基準:【胎児】1)脊髄髄膜瘤に関連しない重篤な先天性奇形
合併例、2)脊椎後弯30度以上、3)多胎である 【母体】1)子宮頸
管長<20㎜、2)早産既往、3)子宮頸管無力症、4)常位胎盤早期剥
離の既往、5)前置胎盤、6)肥満、7)妊娠前からのインスリン治療
を要する糖尿病、8)Rh血液型不適合、9)母体HIVウイルス陽性、
B型肝炎ウイルスHBs抗原陽性、C型肝炎ウイルス抗体陽性、10)
子宮奇形、11)既往子宮手術、12)社会的サポートが得られない、
13)精神的疾患を有する、14)その他、研究責任者、又は研究分担
者が本研究の対象として不適当と判断したもの
予想される有害事象:①母体有害事象:母体死亡、子宮内感染、
常位胎盤早期剥離、等 ②胎児有害事象:胎児死亡、等
先進医療
・ 試験名:脊髄髄膜瘤胎児手術の有効性及び安全
性の検討
・ 試験デザイン:非盲検非対照試験
・ 期間:先進医療告示適用日より4年間
・ 被験者数:10例
・ 主要評価項目:出生12ヵ月後での後脳ヘルニア
の有病割合
・ 副次評価項目:
出生12ヵ月後での脳室腹腔内シャントの有無
出生12ヵ月後までの乳児死亡
手術の完遂
母体、胎児/乳児に発生した有害事象
保
険
収
載
海外での現状
保険適用:米国(有)、英国(有)、ベルギー(有)、オーストラリア(無)
ガイドライン記載:(有:米国)
→産科的リスクはあるが、脊髄髄膜瘤胎児手術は選択基準に適合した女性に
とっては、治療選択の一つである。
Practice Bulletin No. 187: Neural Tube Defect
進行中の臨床試験(無)
本邦での現状
ガイドライン記載:(無)
進行中の臨床試験(有)→上記の「脊髄髄膜瘤胎児手術の早期安全性評価試験」