よむ、つかう、まなぶ。
資料4-2 抗がんWG[498KB] (17 ページ)
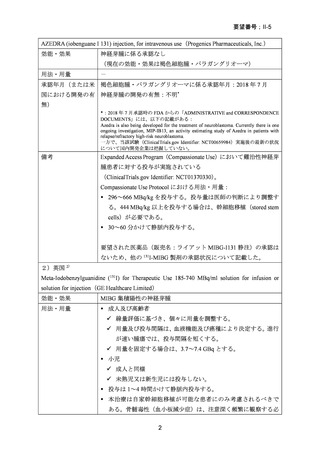
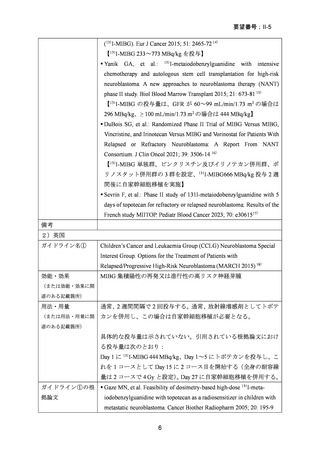
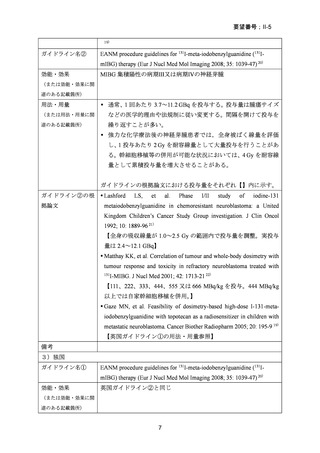
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;II-5
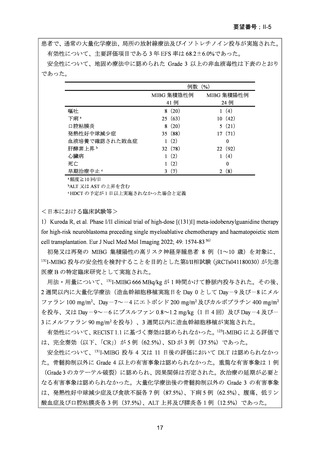
患者で、通常の大量化学療法、局所の放射線療法及びイソトレチノイン投与が実施された。
有効性について、主要評価項目である 3 年 EFS 率は 68.2±6.0%であった。
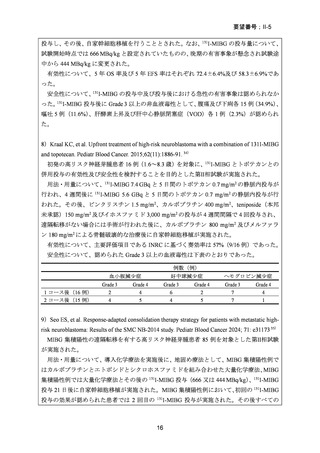
安全性について、地固め療法中に認められた Grade 3 以上の非血液毒性は下表のとおり
であった。
例数(%)
MIBG 集積陰性例
41 例
MIBG 集積陽性例
24 例
8(20)
25(63)
8(20)
35(88)
1(2)
32(78)
1(2)
1(2)
3(7)
1(4)
10(42)
5(21)
17(71)
0
22(92)
1(4)
0
2(8)
嘔吐
下痢 a
口腔粘膜炎
発熱性好中球減少症
血液培養で確認された敗血症
肝酵素上昇 b
心臓病
死亡
早期治療中止 c
a 頻度≧10 回/日
bALT 又は AST の上昇を含む
c HDCT の予定が 1 日以上実施されなかった場合と定義
<日本における臨床試験等>
1)Kuroda R, et al. Phase I/II clinical trial of high-dose [(131)I] meta-iodobenzylguanidine therapy
for high-risk neuroblastoma preceding single myeloablative chemotherapy and haematopoietic stem
cell transplantation. Eur J Nucl Med Mol Imaging 2022; 49: 1574-83 36)
初発又は再発の MIBG 集積陽性の高リスク神経芽腫患者 8 例(1~10 歳)を対象に、
131
I-MIBG 投与の安全性を検討することを目的とした第Ⅰ/Ⅱ相試験(jRCTs041180030)が先進
医療 B の特定臨床研究として実施された。
用法・用量について、131I-MIBG 666 MBq/kg が 1 時間かけて静脈内投与された。その後、
2 週間以内に大量化学療法(造血幹細胞移植実施日を Day 0 として Day-9 及び-8 にメル
ファラン 100 mg/m2、Day-7~-4 にエトポシド 200 mg/m2 及びカルボプラチン 400 mg/m2
を投与、又は Day-9~-6 にブスルファン 0.8~1.2 mg/kg(1 日 4 回)及び Day-4 及び-
3 にメルファラン 90 mg/m2 を投与)、3 週間以内に造血幹細胞移植が実施された。
有効性について、RECIST 1.1 に基づく奏効は認められなかった。123I-MIBG による評価で
は、完全奏効(以下、
「CR」)が 5 例(62.5%)
、SD が 3 例(37.5%)であった。
安全性について、131I-MIBG 投与 4 又は 11 日後の評価において DLT は認められなかっ
た。骨髄抑制以外に Grade 4 以上の有害事象は認められなかった。重篤な有害事象は 1 例
(Grade 3 のカテーテル破裂)に認められ、因果関係は否定された。次治療の延期が必要と
なる有害事象は認められなかった。大量化学療法後の骨髄抑制以外の Grade 3 の有害事象
は、発熱性好中球減少症及び食欲不振各 7 例(87.5%)
、下痢 5 例(62.5%)
、腹痛、低リン
酸血症及び口腔粘膜炎各 3 例(37.5%)、ALT 上昇及び膵炎各 1 例(12.5%)であった。
17
患者で、通常の大量化学療法、局所の放射線療法及びイソトレチノイン投与が実施された。
有効性について、主要評価項目である 3 年 EFS 率は 68.2±6.0%であった。
安全性について、地固め療法中に認められた Grade 3 以上の非血液毒性は下表のとおり
であった。
例数(%)
MIBG 集積陰性例
41 例
MIBG 集積陽性例
24 例
8(20)
25(63)
8(20)
35(88)
1(2)
32(78)
1(2)
1(2)
3(7)
1(4)
10(42)
5(21)
17(71)
0
22(92)
1(4)
0
2(8)
嘔吐
下痢 a
口腔粘膜炎
発熱性好中球減少症
血液培養で確認された敗血症
肝酵素上昇 b
心臓病
死亡
早期治療中止 c
a 頻度≧10 回/日
bALT 又は AST の上昇を含む
c HDCT の予定が 1 日以上実施されなかった場合と定義
<日本における臨床試験等>
1)Kuroda R, et al. Phase I/II clinical trial of high-dose [(131)I] meta-iodobenzylguanidine therapy
for high-risk neuroblastoma preceding single myeloablative chemotherapy and haematopoietic stem
cell transplantation. Eur J Nucl Med Mol Imaging 2022; 49: 1574-83 36)
初発又は再発の MIBG 集積陽性の高リスク神経芽腫患者 8 例(1~10 歳)を対象に、
131
I-MIBG 投与の安全性を検討することを目的とした第Ⅰ/Ⅱ相試験(jRCTs041180030)が先進
医療 B の特定臨床研究として実施された。
用法・用量について、131I-MIBG 666 MBq/kg が 1 時間かけて静脈内投与された。その後、
2 週間以内に大量化学療法(造血幹細胞移植実施日を Day 0 として Day-9 及び-8 にメル
ファラン 100 mg/m2、Day-7~-4 にエトポシド 200 mg/m2 及びカルボプラチン 400 mg/m2
を投与、又は Day-9~-6 にブスルファン 0.8~1.2 mg/kg(1 日 4 回)及び Day-4 及び-
3 にメルファラン 90 mg/m2 を投与)、3 週間以内に造血幹細胞移植が実施された。
有効性について、RECIST 1.1 に基づく奏効は認められなかった。123I-MIBG による評価で
は、完全奏効(以下、
「CR」)が 5 例(62.5%)
、SD が 3 例(37.5%)であった。
安全性について、131I-MIBG 投与 4 又は 11 日後の評価において DLT は認められなかっ
た。骨髄抑制以外に Grade 4 以上の有害事象は認められなかった。重篤な有害事象は 1 例
(Grade 3 のカテーテル破裂)に認められ、因果関係は否定された。次治療の延期が必要と
なる有害事象は認められなかった。大量化学療法後の骨髄抑制以外の Grade 3 の有害事象
は、発熱性好中球減少症及び食欲不振各 7 例(87.5%)
、下痢 5 例(62.5%)
、腹痛、低リン
酸血症及び口腔粘膜炎各 3 例(37.5%)、ALT 上昇及び膵炎各 1 例(12.5%)であった。
17