よむ、つかう、まなぶ。
参考資料5 新型コロナワクチン「ダイチロナ筋注」(第一三共株式会社)添付文書[335KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00138.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第106回 4/14)医薬品等安全対策部会安全対策調査会(令和7年度第1回 4/14)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
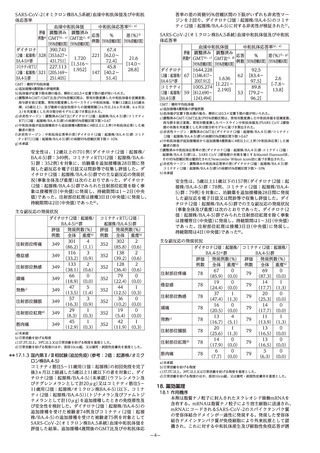
参考資料5
**2025年 3 月改訂(第 6 版、用法及び用量変更)
*2024年 9 月改訂(第 5 版)
05
日本標準商品分類番号
876313
貯法:2~8℃で保存
有効期間:7ヵ月
ウイルスワクチン類
劇薬、処方箋医薬品
注)
生物学的製剤基準
承認番号
30500AMX00171
販売開始
2023年12月
コロナウイルス(SARS-CoV-2)RNAワクチン
注)
注意―医師等の処方箋により使用すること
7.3 接種回数
過去にSARS-CoV-2ワクチンの接種歴のない者には、お
よそ4週間の間隔をおいて2回目接種を行うことができる。
[8.8 参照]
7.4 同時接種
医師が必要と認めた場合には、他のワクチンと同時に接
種することができる。[14.2.2 参照]
2. 接種不適当者
(予防接種を受けることが適当でない者)
2.1 明らかな発熱を呈している者
2.2 重篤な急性疾患にかかっていることが明らかな者
2.3 本剤の成分に対し、重度の過敏症の既往歴のある者
[8.4、11.1.1 参照]
2.4 上記に掲げる者のほか、予防接種を行うことが不適
当な状態にある者
8. 重要な基本的注意
3. 製法の概要及び組成・性状
*3.1 製法の概要
SARS-CoV-2のスパイクタンパク質の受容体結合ドメイ
ンをコードするDNAを鋳型として転写したRNAを精製し、
脂質ナノ粒子内に封入する。なお、本剤は製造工程でウ
シの乳由来成分
(カゼインペプトン)
を使用している。
抗原として用いる株
(抗原株)
は下表のとおり。
抗原株
*3.2 組成
SARS-CoV-2 オミクロン株JN.1 系統
添加剤
1バイアル中
(7R,9Z,26Z,29R)
-18(
{
[3(ジメチル
アミノ)プロポキシ]カルボニル}オキ
シ)ペンタトリアコンタ-9,26-ジエ
SARS-CoV-2
ン-7,29-ジイル=ジアセタート
(T168のスパイクタ
1857a)1602μg、コレステロール
ンパク質の受
752.0μg、1,2-ジステアロイル-sn-グ
ダイチロナ
容体結合部位
リセロ-3-ホスホコリン(DSPC)468.5
筋注
(RBD)をコー
μg、1,2-ジミリストイル-rac-グリセ
ドするmRNA
ロ-3-メチルポリオキシエチレン
150.0μg/1.5mL
(PEG2000-DMG)177.9μg、精製白糖
154.0mg、ʟ-ヒスチジン2327μg、pH
調節剤
販売名
有効成分
3.3 製剤の性状
販売名
性状
pH
ダイチロナ
筋注
浸透圧比
(生理食塩液対比)
白濁した液
6.5~7.5
1.0~1.4
4. 効能又は効果
SARS-CoV-2による感染症の予防
5. 効能又は効果に関連する注意
5.1 本剤の予防効果の持続期間は確立していない。
9. 特定の背景を有する者に関する注意
**6. 用法及び用量
〈12歳以上〉
1回0.6mLを筋肉内に接種する。
〈5歳以上11歳以下〉
1回0.2mLを筋肉内に接種する。
7. 用法及び用量に関連する注意
**7.1 接種対象者
5歳以上の者
7.2 接種時期
通常、前回のSARS-CoV-2ワクチンの接種から少なくと
も3ヵ月経過した後に接種することができる。
�����
8.1 本剤は「予防接種実施規則」及び「定期接種実施要領」に準
拠して使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察に
よって健康状態を調べること。[9.1 参照]
8.3 被接種者又はその保護者に、接種当日は過激な運動は避
け、接種部位を清潔に保ち、また、接種後の健康監視に
留意し、局所の異常反応や体調の変化、さらに高熱、け
いれん等の異常な症状を呈した場合には速やかに医師の
診察を受けるよう事前に知らせること。
8.4 ショック、アナフィラキシーがあらわれることがあるた
め、接種前に過敏症の既往歴等に関する問診を十分に行
い、接種後一定時間、被接種者の状態を観察することが
望ましい。また、本剤接種後にショック、アナフィラキ
シーが認められた被接種者に対しては、以降の本剤の接
種を行わないこと。[2.3、9.1.6、11.1.1 参照]
8.5 ワクチン接種直後又は接種後に注射による心因性反応を含
む血管迷走神経反射として失神があらわれることがある。
失神による転倒を避けるため、接種後一定時間は座らせる
などした上で被接種者の状態を観察することが望ましい。
8.6 心筋炎、心膜炎があらわれることがあるため、被接種者
又はその保護者に対しては、心筋炎、心膜炎が疑われる
症状(胸痛、動悸、むくみ、呼吸困難、頻呼吸等)が認め
られた場合には、速やかに医師の診察を受けるよう事前
に知らせること。[11.1.2、15.1.1、15.1.2 参照]
8.7 コロナウイルス(SARS-CoV-2)RNAワクチン接種後に、
ギラン・バレー症候群が報告されている。被接種者又は
その保護者に対しては、ギラン・バレー症候群が疑われ
る症状(四肢遠位から始まる弛緩性麻痺、腱反射の減弱な
いし消失等)が認められた場合には直ちに医師等に相談す
るよう、あらかじめ説明すること。
8.8 本剤と他のSARS-CoV-2に対するワクチンの互換性に関
するデータはない。[7.3 参照]
-1-
9.1 接種要注意者
(接種の判断を行うに際し、注意を要する者)
被接種者が次のいずれかに該当すると認められる場合は、
健康状態及び体質を勘案し、診察及び接種適否の判断を
慎重に行い、予防接種の必要性、副反応、有用性につい
て十分な説明を行い、同意を確実に得た上で、注意して
接種すること。[8.2 参照]
9.1.1 血小板減少症又は凝固障害を有する者、抗凝固療法を
施行している者
本剤接種後に出血又は注射部位に内出血があらわれる
おそれがある。
**2025年 3 月改訂(第 6 版、用法及び用量変更)
*2024年 9 月改訂(第 5 版)
05
日本標準商品分類番号
876313
貯法:2~8℃で保存
有効期間:7ヵ月
ウイルスワクチン類
劇薬、処方箋医薬品
注)
生物学的製剤基準
承認番号
30500AMX00171
販売開始
2023年12月
コロナウイルス(SARS-CoV-2)RNAワクチン
注)
注意―医師等の処方箋により使用すること
7.3 接種回数
過去にSARS-CoV-2ワクチンの接種歴のない者には、お
よそ4週間の間隔をおいて2回目接種を行うことができる。
[8.8 参照]
7.4 同時接種
医師が必要と認めた場合には、他のワクチンと同時に接
種することができる。[14.2.2 参照]
2. 接種不適当者
(予防接種を受けることが適当でない者)
2.1 明らかな発熱を呈している者
2.2 重篤な急性疾患にかかっていることが明らかな者
2.3 本剤の成分に対し、重度の過敏症の既往歴のある者
[8.4、11.1.1 参照]
2.4 上記に掲げる者のほか、予防接種を行うことが不適
当な状態にある者
8. 重要な基本的注意
3. 製法の概要及び組成・性状
*3.1 製法の概要
SARS-CoV-2のスパイクタンパク質の受容体結合ドメイ
ンをコードするDNAを鋳型として転写したRNAを精製し、
脂質ナノ粒子内に封入する。なお、本剤は製造工程でウ
シの乳由来成分
(カゼインペプトン)
を使用している。
抗原として用いる株
(抗原株)
は下表のとおり。
抗原株
*3.2 組成
SARS-CoV-2 オミクロン株JN.1 系統
添加剤
1バイアル中
(7R,9Z,26Z,29R)
-18(
{
[3(ジメチル
アミノ)プロポキシ]カルボニル}オキ
シ)ペンタトリアコンタ-9,26-ジエ
SARS-CoV-2
ン-7,29-ジイル=ジアセタート
(T168のスパイクタ
1857a)1602μg、コレステロール
ンパク質の受
752.0μg、1,2-ジステアロイル-sn-グ
ダイチロナ
容体結合部位
リセロ-3-ホスホコリン(DSPC)468.5
筋注
(RBD)をコー
μg、1,2-ジミリストイル-rac-グリセ
ドするmRNA
ロ-3-メチルポリオキシエチレン
150.0μg/1.5mL
(PEG2000-DMG)177.9μg、精製白糖
154.0mg、ʟ-ヒスチジン2327μg、pH
調節剤
販売名
有効成分
3.3 製剤の性状
販売名
性状
pH
ダイチロナ
筋注
浸透圧比
(生理食塩液対比)
白濁した液
6.5~7.5
1.0~1.4
4. 効能又は効果
SARS-CoV-2による感染症の予防
5. 効能又は効果に関連する注意
5.1 本剤の予防効果の持続期間は確立していない。
9. 特定の背景を有する者に関する注意
**6. 用法及び用量
〈12歳以上〉
1回0.6mLを筋肉内に接種する。
〈5歳以上11歳以下〉
1回0.2mLを筋肉内に接種する。
7. 用法及び用量に関連する注意
**7.1 接種対象者
5歳以上の者
7.2 接種時期
通常、前回のSARS-CoV-2ワクチンの接種から少なくと
も3ヵ月経過した後に接種することができる。
�����
8.1 本剤は「予防接種実施規則」及び「定期接種実施要領」に準
拠して使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察に
よって健康状態を調べること。[9.1 参照]
8.3 被接種者又はその保護者に、接種当日は過激な運動は避
け、接種部位を清潔に保ち、また、接種後の健康監視に
留意し、局所の異常反応や体調の変化、さらに高熱、け
いれん等の異常な症状を呈した場合には速やかに医師の
診察を受けるよう事前に知らせること。
8.4 ショック、アナフィラキシーがあらわれることがあるた
め、接種前に過敏症の既往歴等に関する問診を十分に行
い、接種後一定時間、被接種者の状態を観察することが
望ましい。また、本剤接種後にショック、アナフィラキ
シーが認められた被接種者に対しては、以降の本剤の接
種を行わないこと。[2.3、9.1.6、11.1.1 参照]
8.5 ワクチン接種直後又は接種後に注射による心因性反応を含
む血管迷走神経反射として失神があらわれることがある。
失神による転倒を避けるため、接種後一定時間は座らせる
などした上で被接種者の状態を観察することが望ましい。
8.6 心筋炎、心膜炎があらわれることがあるため、被接種者
又はその保護者に対しては、心筋炎、心膜炎が疑われる
症状(胸痛、動悸、むくみ、呼吸困難、頻呼吸等)が認め
られた場合には、速やかに医師の診察を受けるよう事前
に知らせること。[11.1.2、15.1.1、15.1.2 参照]
8.7 コロナウイルス(SARS-CoV-2)RNAワクチン接種後に、
ギラン・バレー症候群が報告されている。被接種者又は
その保護者に対しては、ギラン・バレー症候群が疑われ
る症状(四肢遠位から始まる弛緩性麻痺、腱反射の減弱な
いし消失等)が認められた場合には直ちに医師等に相談す
るよう、あらかじめ説明すること。
8.8 本剤と他のSARS-CoV-2に対するワクチンの互換性に関
するデータはない。[7.3 参照]
-1-
9.1 接種要注意者
(接種の判断を行うに際し、注意を要する者)
被接種者が次のいずれかに該当すると認められる場合は、
健康状態及び体質を勘案し、診察及び接種適否の判断を
慎重に行い、予防接種の必要性、副反応、有用性につい
て十分な説明を行い、同意を確実に得た上で、注意して
接種すること。[8.2 参照]
9.1.1 血小板減少症又は凝固障害を有する者、抗凝固療法を
施行している者
本剤接種後に出血又は注射部位に内出血があらわれる
おそれがある。