よむ、つかう、まなぶ。
新型コロナウイルスワクチンの製造販売承認について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25294.html |
| 出典情報 | 新型コロナウイルスワクチンの製造販売承認について(4/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
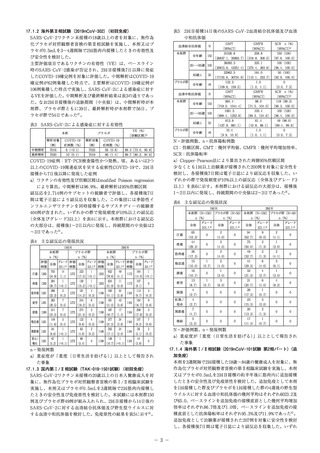
2022年4月作成(第1版)
日本標準商品分類番号
876313
ウイルスワクチン類
貯法:凍結を避け2~8℃で保存
有効期間:9ヵ月
生物学的製剤基準
組換えコロナウイルス(SARS-CoV-2)ワクチン
生物由来製品、劇薬、処方箋医薬品注)
注)注意-医師等の処方箋により使用すること
3. 製法の概要及び組成・性状
3.1 製法の概要
本剤はSARS-CoV-2の組換えスパイク蛋白質(rS)抗原を含有
する。スパイク(S)蛋白質は、組換えバキュロウイルス発現系
を用い、無血清培地を使用して製造する。ツマジロクサヨトウ
由来細胞内でS蛋白質をコードする組換えバキュロウイルスが増
殖すると、細胞質中にS蛋白質が発現する。細胞を破壊してS蛋
白質を遊離させ、一連のクロマトグラフィー及びろ過によって
精製する。精製されたS蛋白質を、Quillaja saponaria Molina の
樹皮の特定の部分精製抽出物、コレステロール及びホスファチ
ジルコリンからなるMatrix-M(Matrix-A及びMatrix-Cの混合
物)並びに添加剤と配合する。
3.2 組成
本剤は、0.5mL中に次の成分を含有する。
5μg
42.5μg
Matrix-C注)
7.5μg
リン酸水素二ナトリウム七水和物
2.465mg
リン酸二水素ナトリウム一水和物
0.445mg
塩化ナトリウム
8.766mg
ポリソルベート80
0.05mg
7.1 接種対象者
本剤の接種は18歳以上の者に行う。
SARS-CoV-2の流行状況や個々の背景因子等を踏まえ、ベネ
フィットとリスクを考慮し、追加免疫の要否を判断すること。
7.2 接種回数
初回免疫:本剤は2回接種により効果が確認されていることか
ら、原則として、他のSARS-CoV-2に対するワクチンと混同す
ることなく2回接種するよう注意すること。
7.3 接種間隔
初回免疫:1回目の接種から3週間を超えた場合には、できる限
り速やかに2回目の接種を実施すること。
追加免疫:通常、本剤2回目の接種から少なくとも6ヵ月経過し
た後に3回目の接種を行うことができる。
8. 重要な基本的注意
8.1 本剤は、「予防接種実施規則」及び「新型コロナウイルス感染
症に係る臨時の予防接種実施要領」に準拠して使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察によっ
て健康状態を調べること。[9.1参照]
8.3 ショック、アナフィラキシーがあらわれることがあるため、接
種前に過敏症の既往歴等に関する問診を十分に行い、接種後一定
時間、被接種者の状態を観察することが望ましい。また、本剤の
接種でショック、アナフィラキシーが発現したことがある者には、
以降、本剤の接種は行わないこと。
[2.3、9.1.4、9.1.6、11.1.1参照]
8.4 被接種者又はその保護者に、接種当日は過激な運動は避け、
接種部位を清潔に保ち、また、接種後の健康監視に留意し、局
所の異常反応及び体調の変化、さらに高熱、けいれん等の異常
な症状を呈した場合には、速やかに医師の診察を受けるよう事
前に知らせること。
8.5 ワクチン接種直後又は接種後に注射による心因性反応を含む
pH調節剤
血管迷走神経反射として失神があらわれることがある。失神に
よる転倒を避けるため、接種後一定時間は座らせるなどした上
で被接種者の状態を観察することが望ましい。
注)添加剤として、コレステロール、ホスファチジルコリン、リ
ン酸水素二ナトリウム二水和物、リン酸二水素カリウム、塩
化カリウム及び塩化ナトリウムを含む
8.6 初回免疫時の本剤と他のSARS-CoV-2に対するワクチンの互
換性に関するデータはない。
8.7 他のSARS-CoV-2に対するワクチン接種後に本剤を用いて追
3.3 製剤の性状
販売名
剤形・性状
pH
浸透圧比
-
7. 用法及び用量に関連する注意
2.2 重篤な急性疾患にかかっていることが明らかな者
2.3 本剤の成分に対し、重度の過敏症の既往歴のある者[8.3、
11.1.1参照]
2.4 上記に掲げる者のほか、予防接種を行うことが不適当な状
態にある者
ヌバキソビッド 筋注
SARS-CoV-2 rS
Matrix-A注)
30400AMX00192
販売開始
追加免疫:1回0.5mLを筋肉内に接種する。
2. 接種不適当者(予防接種を受けることが適当でない者)
2.1 明らかな発熱を呈している者
販売名
有効成分
添加剤
承認番号
ヌバキソビッド 筋注
本品は無色から僅かに黄色い、澄明から乳白光を呈
する液
6.7~7.7
約2(生理食塩液に対する比)
加免疫した際の有効性、安全性は確立されていない。
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
被接種者が次のいずれかに該当すると認められる場合には、健
4. 効能又は効果
SARS-CoV-2による感染症の予防
康状態及び体質を勘案し、診察及び接種適否の判断を慎重に行
い、予防接種の必要性、副反応、有用性について十分な説明を
行い、同意を確実に得た上で、注意して接種すること。
[8.2参照]
9.1.1 血小板減少症又は凝固障害を有する者、抗凝固療法を施行
5. 効能又は効果に関連する注意
5.1 本剤の予防効果の持続期間は確立していない。
6. 用法及び用量
初回免疫:1回0.5mLを2回、通常、3週間の間隔をおいて、筋肉
内に接種する。
-1-
している者
本剤接種後に出血又は注射部位に内出血があらわれるおそれがある。
日本標準商品分類番号
876313
ウイルスワクチン類
貯法:凍結を避け2~8℃で保存
有効期間:9ヵ月
生物学的製剤基準
組換えコロナウイルス(SARS-CoV-2)ワクチン
生物由来製品、劇薬、処方箋医薬品注)
注)注意-医師等の処方箋により使用すること
3. 製法の概要及び組成・性状
3.1 製法の概要
本剤はSARS-CoV-2の組換えスパイク蛋白質(rS)抗原を含有
する。スパイク(S)蛋白質は、組換えバキュロウイルス発現系
を用い、無血清培地を使用して製造する。ツマジロクサヨトウ
由来細胞内でS蛋白質をコードする組換えバキュロウイルスが増
殖すると、細胞質中にS蛋白質が発現する。細胞を破壊してS蛋
白質を遊離させ、一連のクロマトグラフィー及びろ過によって
精製する。精製されたS蛋白質を、Quillaja saponaria Molina の
樹皮の特定の部分精製抽出物、コレステロール及びホスファチ
ジルコリンからなるMatrix-M(Matrix-A及びMatrix-Cの混合
物)並びに添加剤と配合する。
3.2 組成
本剤は、0.5mL中に次の成分を含有する。
5μg
42.5μg
Matrix-C注)
7.5μg
リン酸水素二ナトリウム七水和物
2.465mg
リン酸二水素ナトリウム一水和物
0.445mg
塩化ナトリウム
8.766mg
ポリソルベート80
0.05mg
7.1 接種対象者
本剤の接種は18歳以上の者に行う。
SARS-CoV-2の流行状況や個々の背景因子等を踏まえ、ベネ
フィットとリスクを考慮し、追加免疫の要否を判断すること。
7.2 接種回数
初回免疫:本剤は2回接種により効果が確認されていることか
ら、原則として、他のSARS-CoV-2に対するワクチンと混同す
ることなく2回接種するよう注意すること。
7.3 接種間隔
初回免疫:1回目の接種から3週間を超えた場合には、できる限
り速やかに2回目の接種を実施すること。
追加免疫:通常、本剤2回目の接種から少なくとも6ヵ月経過し
た後に3回目の接種を行うことができる。
8. 重要な基本的注意
8.1 本剤は、「予防接種実施規則」及び「新型コロナウイルス感染
症に係る臨時の予防接種実施要領」に準拠して使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察によっ
て健康状態を調べること。[9.1参照]
8.3 ショック、アナフィラキシーがあらわれることがあるため、接
種前に過敏症の既往歴等に関する問診を十分に行い、接種後一定
時間、被接種者の状態を観察することが望ましい。また、本剤の
接種でショック、アナフィラキシーが発現したことがある者には、
以降、本剤の接種は行わないこと。
[2.3、9.1.4、9.1.6、11.1.1参照]
8.4 被接種者又はその保護者に、接種当日は過激な運動は避け、
接種部位を清潔に保ち、また、接種後の健康監視に留意し、局
所の異常反応及び体調の変化、さらに高熱、けいれん等の異常
な症状を呈した場合には、速やかに医師の診察を受けるよう事
前に知らせること。
8.5 ワクチン接種直後又は接種後に注射による心因性反応を含む
pH調節剤
血管迷走神経反射として失神があらわれることがある。失神に
よる転倒を避けるため、接種後一定時間は座らせるなどした上
で被接種者の状態を観察することが望ましい。
注)添加剤として、コレステロール、ホスファチジルコリン、リ
ン酸水素二ナトリウム二水和物、リン酸二水素カリウム、塩
化カリウム及び塩化ナトリウムを含む
8.6 初回免疫時の本剤と他のSARS-CoV-2に対するワクチンの互
換性に関するデータはない。
8.7 他のSARS-CoV-2に対するワクチン接種後に本剤を用いて追
3.3 製剤の性状
販売名
剤形・性状
pH
浸透圧比
-
7. 用法及び用量に関連する注意
2.2 重篤な急性疾患にかかっていることが明らかな者
2.3 本剤の成分に対し、重度の過敏症の既往歴のある者[8.3、
11.1.1参照]
2.4 上記に掲げる者のほか、予防接種を行うことが不適当な状
態にある者
ヌバキソビッド 筋注
SARS-CoV-2 rS
Matrix-A注)
30400AMX00192
販売開始
追加免疫:1回0.5mLを筋肉内に接種する。
2. 接種不適当者(予防接種を受けることが適当でない者)
2.1 明らかな発熱を呈している者
販売名
有効成分
添加剤
承認番号
ヌバキソビッド 筋注
本品は無色から僅かに黄色い、澄明から乳白光を呈
する液
6.7~7.7
約2(生理食塩液に対する比)
加免疫した際の有効性、安全性は確立されていない。
9. 特定の背景を有する者に関する注意
9.1 接種要注意者(接種の判断を行うに際し、注意を要する者)
被接種者が次のいずれかに該当すると認められる場合には、健
4. 効能又は効果
SARS-CoV-2による感染症の予防
康状態及び体質を勘案し、診察及び接種適否の判断を慎重に行
い、予防接種の必要性、副反応、有用性について十分な説明を
行い、同意を確実に得た上で、注意して接種すること。
[8.2参照]
9.1.1 血小板減少症又は凝固障害を有する者、抗凝固療法を施行
5. 効能又は効果に関連する注意
5.1 本剤の予防効果の持続期間は確立していない。
6. 用法及び用量
初回免疫:1回0.5mLを2回、通常、3週間の間隔をおいて、筋肉
内に接種する。
-1-
している者
本剤接種後に出血又は注射部位に内出血があらわれるおそれがある。