よむ、つかう、まなぶ。
令和3年度の安全対策について(概要) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00011.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和4年度第1回 7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
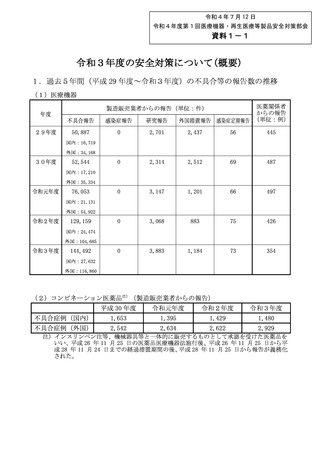
令和4年7月 12 日
令和4年度第1回医療機器・再生医療等製品安全対策部会
資料1-1
令和3年度の安全対策について(概要)
1.過去5年間(平成 29 年度~令和3年度)の不具合等の報告数の推移
(1)医療機器
年度
29年度
医薬関係者
からの報告
(単位:例)
外国措置報告 感染症定期報告
製造販売業者からの報告(単位:件)
不具合報告
感染症報告
研究報告
50,887
0
2,701
2,437
56
445
0
2,314
2,512
69
487
0
3,147
1,201
66
497
0
3,068
883
75
426
0
3,883
1,184
73
354
国内:16,719
外国:34,168
30年度
52,544
国内:17,210
外国:35,334
令和元年度
76,053
国内:21,131
外国:54,922
令和2年度
129,159
国内:24,474
外国:104,685
令和3年度
144,492
国内:27,632
外国:116,860
(2)コンビネーション医薬品注)(製造販売業者からの報告)
平成 30 年度
令和元年度
令和2年度
令和3年度
不具合症例(国内)
1,653
1,395
1,429
1,480
不具合症例(外国)
2,542
2,634
2,622
2,929
注)インスリンペン注等、機械器具等と一体的に販売するものとして承認を受けた医薬品を
いい、平成 26 年 11 月 25 日の医薬品医療機器法施行後、平成 26 年 11 月 25 日から平
成 28 年 11 月 24 日までの経過措置期間の後、平成 28 年 11 月 25 日から報告が義務化
された。
令和4年度第1回医療機器・再生医療等製品安全対策部会
資料1-1
令和3年度の安全対策について(概要)
1.過去5年間(平成 29 年度~令和3年度)の不具合等の報告数の推移
(1)医療機器
年度
29年度
医薬関係者
からの報告
(単位:例)
外国措置報告 感染症定期報告
製造販売業者からの報告(単位:件)
不具合報告
感染症報告
研究報告
50,887
0
2,701
2,437
56
445
0
2,314
2,512
69
487
0
3,147
1,201
66
497
0
3,068
883
75
426
0
3,883
1,184
73
354
国内:16,719
外国:34,168
30年度
52,544
国内:17,210
外国:35,334
令和元年度
76,053
国内:21,131
外国:54,922
令和2年度
129,159
国内:24,474
外国:104,685
令和3年度
144,492
国内:27,632
外国:116,860
(2)コンビネーション医薬品注)(製造販売業者からの報告)
平成 30 年度
令和元年度
令和2年度
令和3年度
不具合症例(国内)
1,653
1,395
1,429
1,480
不具合症例(外国)
2,542
2,634
2,622
2,929
注)インスリンペン注等、機械器具等と一体的に販売するものとして承認を受けた医薬品を
いい、平成 26 年 11 月 25 日の医薬品医療機器法施行後、平成 26 年 11 月 25 日から平
成 28 年 11 月 24 日までの経過措置期間の後、平成 28 年 11 月 25 日から報告が義務化
された。