よむ、つかう、まなぶ。
資料2-2 先進医療B評価表(整理番号129) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26539.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第136回 7/14)《厚生労働省》 |
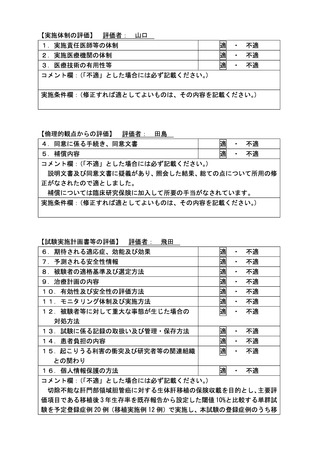
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
植に至らない非移植例についてもデータを収集する計画です。試験の無効中止基準
として、移植後 60 日以内の死亡例が 3 例超えないことが設定されています。
本試験では日本肝胆膵外科学会の定める高度技能専門医修練施設で生体肝移植
を実施する計画であることから、施設間及び術者間の違いが評価に与える影響につい
てはほとんどないと考察されています。
予定登録症例数 20 例については、最大 8 例の非移植例を見込み、8 例を超えた
場合には研究の継続の可否を判断する計画であること、生体肝移植群が少数にとど
まった場合でも移植患者が 7 例以上であれば検出力及び実施可能性の観点から許容
することが規定されています。
実施計画書として適切に計画されていますので、いずれも適と評価いたしまし
た。
実施条件欄:(修正すれば適としてよいものは、その内容を記載ください。)
確認事項
【1~16の総評】
総合評価
適
条件付き適
継続審議
不適
先進医療告示日から 9 年
予定症例数 20 例
予定試験期間
(登録期間:5 年、追跡期
間 3 年、解析期間 1 年)
実施条件:
コメント欄(不適とした場合は、その理由を必ず記載ください。)
(修正すれば適となる場合は、修正内容を記載ください。)
高度に進行した肝門部領域胆管癌に新しい治療選択肢を示そうとする、新しい試
みである。高度の技術と万全の体制が必要な移植医療であり、ドナーおよびレシピ
エントの安全性を確認しつつ慎重に進めて頂きたい。
として、移植後 60 日以内の死亡例が 3 例超えないことが設定されています。
本試験では日本肝胆膵外科学会の定める高度技能専門医修練施設で生体肝移植
を実施する計画であることから、施設間及び術者間の違いが評価に与える影響につい
てはほとんどないと考察されています。
予定登録症例数 20 例については、最大 8 例の非移植例を見込み、8 例を超えた
場合には研究の継続の可否を判断する計画であること、生体肝移植群が少数にとど
まった場合でも移植患者が 7 例以上であれば検出力及び実施可能性の観点から許容
することが規定されています。
実施計画書として適切に計画されていますので、いずれも適と評価いたしまし
た。
実施条件欄:(修正すれば適としてよいものは、その内容を記載ください。)
確認事項
【1~16の総評】
総合評価
適
条件付き適
継続審議
不適
先進医療告示日から 9 年
予定症例数 20 例
予定試験期間
(登録期間:5 年、追跡期
間 3 年、解析期間 1 年)
実施条件:
コメント欄(不適とした場合は、その理由を必ず記載ください。)
(修正すれば適となる場合は、修正内容を記載ください。)
高度に進行した肝門部領域胆管癌に新しい治療選択肢を示そうとする、新しい試
みである。高度の技術と万全の体制が必要な移植医療であり、ドナーおよびレシピ
エントの安全性を確認しつつ慎重に進めて頂きたい。