よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて-1-2 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00133.html |
| 出典情報 | 中央社会保険医療協議会 総会(第510回 1/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【安全性】
国際共同第Ⅲ相試験(KEYNOTE-775/E7080-309 試験)
有害事象は本剤/レンバチニブ群 405/406 例(99.8%)、化学療法群 386/388 例(99.5%)
に認められ、治験薬との因果関係が否定できない有害事象は、それぞれ 395/406 例
(97.3%)及び 364/388 例(93.8%)に認められた。いずれかの群で発現割合が 5%以上の
副作用は下表のとおりであった。
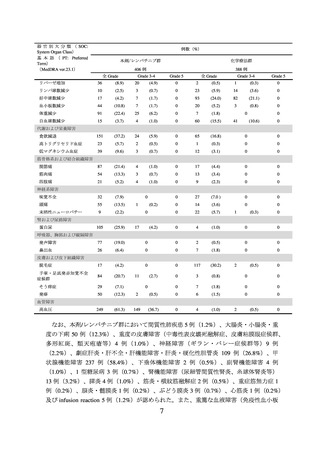
表 2 いずれかの群で発現割合が 5%以上の副作用(KEYNOTE-775/E7080-309 試験)(安全性解析対象集団)
器 官 別 大 分 類 ( SOC:
System Organ Class)
基 本 語 ( PT: Preferred
Term)
(MedDRA ver.23.1)
例数(%)
本剤/レンバチニブ群
406 例
全 Grade
全副作用
化学療法群
388 例
Grade 3-4
全 Grade
Grade 5
395
(97.3)
314
(77.3)
6
(1.5)
57
(14.0)
8
(2.0)
発熱性好中球減少症
1
(0.2)
1
(0.2)
白血球減少症
20
(4.9)
リンパ球減少症
15
(3.7)
2
(0.5)
0
好中球減少症
24
(5.9)
4
(1.0)
0
血小板減少症
33
(8.1)
4
(1.0)
0
22
甲状腺機能亢進症
42
(10.3)
4
(1.0)
0
1
甲状腺機能低下症
222
(54.7)
4
(1.0)
0
腹痛
34
(8.4)
4
(1.0)
0
13
上腹部痛
29
(7.1)
0
12
0
53
(13.7)
0
42
(10.8)
Grade 3-4
Grade 5
364
(93.8)
230
(59.3)
9
(2.3)
0
150
(38.7)
45
(11.6)
0
0
21
(5.4)
21
(5.4)
0
0
48
(12.4)
27
(7.0)
0
26
(6.7)
11
(2.8)
0
129
(33.2)
96
(24.7)
0
(5.7)
4
(1.0)
0
血液およびリンパ系障害
貧血
0
内分泌障害
(0.3)
0
0
0
0
(3.4)
0
0
(3.1)
0
0
0
胃腸障害
便秘
36
(8.9)
下痢
171
(42.1)
口内乾燥
34
(8.4)
悪心
158
(38.9)
口内炎
70
嘔吐
98
0
0
26
(6.4)
0
0
3
0
(0.8)
0
0
0
10
(2.6)
12
(3.0)
0
157
(40.5)
4
(1.0)
0
0
(17.2)
8
(2.0)
0
46
(11.9)
2
(0.5)
0
(24.1)
10
(2.5)
0
60
(15.5)
7
(1.8)
0
一般・全身障害および投与部位の状態
無力症
76
(18.7)
17
(4.2)
0
76
(19.6)
9
(2.3)
0
疲労
113
(27.8)
15
(3.7)
0
92
(23.7)
12
(3.1)
0
粘膜の炎症
47
(11.6)
6
(1.5)
0
35
(9.0)
3
(0.8)
0
発熱
26
(6.4)
1
(0.2)
0
4
(1.0)
66
(16.3)
12
(3.0)
0
14
(3.6)
22
(5.4)
6
(1.5)
0
1
(0.3)
62
(15.3)
12
(3.0)
0
12
(3.1)
2
(0.5)
0
27
(6.7)
4
(1.0)
0
5
(1.3)
2
(0.5)
0
42
(10.3)
0
1
(0.3)
0
0
臨床検査
アラニンアミノトランス
フェラーゼ増加
アミラーゼ増加
アスパラギン酸アミノト
ランスフェラーゼ増加
血中アルカリホスファタ
ーゼ増加
血中甲状腺刺激ホルモン
増加
0
6
2
(0.5)
0
0
0
0
0
国際共同第Ⅲ相試験(KEYNOTE-775/E7080-309 試験)
有害事象は本剤/レンバチニブ群 405/406 例(99.8%)、化学療法群 386/388 例(99.5%)
に認められ、治験薬との因果関係が否定できない有害事象は、それぞれ 395/406 例
(97.3%)及び 364/388 例(93.8%)に認められた。いずれかの群で発現割合が 5%以上の
副作用は下表のとおりであった。
表 2 いずれかの群で発現割合が 5%以上の副作用(KEYNOTE-775/E7080-309 試験)(安全性解析対象集団)
器 官 別 大 分 類 ( SOC:
System Organ Class)
基 本 語 ( PT: Preferred
Term)
(MedDRA ver.23.1)
例数(%)
本剤/レンバチニブ群
406 例
全 Grade
全副作用
化学療法群
388 例
Grade 3-4
全 Grade
Grade 5
395
(97.3)
314
(77.3)
6
(1.5)
57
(14.0)
8
(2.0)
発熱性好中球減少症
1
(0.2)
1
(0.2)
白血球減少症
20
(4.9)
リンパ球減少症
15
(3.7)
2
(0.5)
0
好中球減少症
24
(5.9)
4
(1.0)
0
血小板減少症
33
(8.1)
4
(1.0)
0
22
甲状腺機能亢進症
42
(10.3)
4
(1.0)
0
1
甲状腺機能低下症
222
(54.7)
4
(1.0)
0
腹痛
34
(8.4)
4
(1.0)
0
13
上腹部痛
29
(7.1)
0
12
0
53
(13.7)
0
42
(10.8)
Grade 3-4
Grade 5
364
(93.8)
230
(59.3)
9
(2.3)
0
150
(38.7)
45
(11.6)
0
0
21
(5.4)
21
(5.4)
0
0
48
(12.4)
27
(7.0)
0
26
(6.7)
11
(2.8)
0
129
(33.2)
96
(24.7)
0
(5.7)
4
(1.0)
0
血液およびリンパ系障害
貧血
0
内分泌障害
(0.3)
0
0
0
0
(3.4)
0
0
(3.1)
0
0
0
胃腸障害
便秘
36
(8.9)
下痢
171
(42.1)
口内乾燥
34
(8.4)
悪心
158
(38.9)
口内炎
70
嘔吐
98
0
0
26
(6.4)
0
0
3
0
(0.8)
0
0
0
10
(2.6)
12
(3.0)
0
157
(40.5)
4
(1.0)
0
0
(17.2)
8
(2.0)
0
46
(11.9)
2
(0.5)
0
(24.1)
10
(2.5)
0
60
(15.5)
7
(1.8)
0
一般・全身障害および投与部位の状態
無力症
76
(18.7)
17
(4.2)
0
76
(19.6)
9
(2.3)
0
疲労
113
(27.8)
15
(3.7)
0
92
(23.7)
12
(3.1)
0
粘膜の炎症
47
(11.6)
6
(1.5)
0
35
(9.0)
3
(0.8)
0
発熱
26
(6.4)
1
(0.2)
0
4
(1.0)
66
(16.3)
12
(3.0)
0
14
(3.6)
22
(5.4)
6
(1.5)
0
1
(0.3)
62
(15.3)
12
(3.0)
0
12
(3.1)
2
(0.5)
0
27
(6.7)
4
(1.0)
0
5
(1.3)
2
(0.5)
0
42
(10.3)
0
1
(0.3)
0
0
臨床検査
アラニンアミノトランス
フェラーゼ増加
アミラーゼ増加
アスパラギン酸アミノト
ランスフェラーゼ増加
血中アルカリホスファタ
ーゼ増加
血中甲状腺刺激ホルモン
増加
0
6
2
(0.5)
0
0
0
0
0