よむ、つかう、まなぶ。
参考資料6 オミクロン株BA.4-5対応コミナティRTU筋注について(令和4年10月7日第38回厚生科学審議会予防接種・ワクチン分科会資料2) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00053.html |
| 出典情報 | 第87回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第16回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
海外の状況
○
米国においては 2022 年 8 月 31 日に本剤及びモデルナ社の BA.4-5 対応ワク
チンが、欧州においては同年 9 月 15 日に本剤が認可されている。
○
しかしながら、BA.4-5 対応ワクチンの臨床試験は同年 8 月に開始されたと
ころであり、現時点で提示可能なデータは得られておらず、品質及び非臨床デ
ータのみが得られている状況。
審査
(考え方)
○
今般の申請はオミクロン株 BA.4-5 対応ワクチンに関する一部変更承認申請
であり、本申請においては後述する品質及び非臨床データが提出されている。
○
公衆衛生上懸念される変異株(VOC)に対するワクチンの開発のうち、同一
VOC 内の系統間の株変更については、ウイルスの抗原性が大きく異ならない
ことから、株変更前後のワクチンで得られる免疫原性も大きく異ならないこ
とが想定される。
○
従って、オミクロン株 BA.1 対応の 2 価ワクチンにおいて、臨床データを含
めた評価がなされていることを前提に、オミクロン株 BA.4-5 対応の 2 価ワク
チンにおいては、欧米と同様に臨床データがなくとも評価は可能とし、臨床デ
ータの提出を待たずに評価を進め、承認後追って臨床データの提出を求める
こととした。
(品質データ)
○ オミクロン株 BA.4-5 のスパイクタンパク質をコードする mRNA の追加及
び当該追加に対応した規格試験方法の変更について、適切性を確認した。
(非臨床データ)
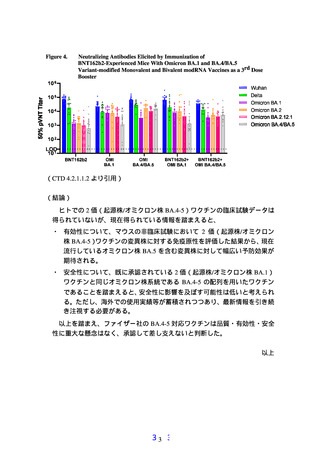
○ ファイザー社はマウスを用いて、1 価(起源株)ワクチンを 2 回接種した後
に、各種 1 価又は 2 価ワクチンを追加接種する非臨床試験を実施した。追加
接種で 2 価(起源株/オミクロン株 BA.4-5)ワクチンを投与したマウスでは、
起源株、デルタ株及びオミクロン株(BA.1、BA.2、BA.2.12.1 及び BA.4/BA.5)
に対して幅広い中和抗体の誘導が認められた。
2 /2 3
○
米国においては 2022 年 8 月 31 日に本剤及びモデルナ社の BA.4-5 対応ワク
チンが、欧州においては同年 9 月 15 日に本剤が認可されている。
○
しかしながら、BA.4-5 対応ワクチンの臨床試験は同年 8 月に開始されたと
ころであり、現時点で提示可能なデータは得られておらず、品質及び非臨床デ
ータのみが得られている状況。
審査
(考え方)
○
今般の申請はオミクロン株 BA.4-5 対応ワクチンに関する一部変更承認申請
であり、本申請においては後述する品質及び非臨床データが提出されている。
○
公衆衛生上懸念される変異株(VOC)に対するワクチンの開発のうち、同一
VOC 内の系統間の株変更については、ウイルスの抗原性が大きく異ならない
ことから、株変更前後のワクチンで得られる免疫原性も大きく異ならないこ
とが想定される。
○
従って、オミクロン株 BA.1 対応の 2 価ワクチンにおいて、臨床データを含
めた評価がなされていることを前提に、オミクロン株 BA.4-5 対応の 2 価ワク
チンにおいては、欧米と同様に臨床データがなくとも評価は可能とし、臨床デ
ータの提出を待たずに評価を進め、承認後追って臨床データの提出を求める
こととした。
(品質データ)
○ オミクロン株 BA.4-5 のスパイクタンパク質をコードする mRNA の追加及
び当該追加に対応した規格試験方法の変更について、適切性を確認した。
(非臨床データ)
○ ファイザー社はマウスを用いて、1 価(起源株)ワクチンを 2 回接種した後
に、各種 1 価又は 2 価ワクチンを追加接種する非臨床試験を実施した。追加
接種で 2 価(起源株/オミクロン株 BA.4-5)ワクチンを投与したマウスでは、
起源株、デルタ株及びオミクロン株(BA.1、BA.2、BA.2.12.1 及び BA.4/BA.5)
に対して幅広い中和抗体の誘導が認められた。
2 /2 3