よむ、つかう、まなぶ。
資料2 先進医療Bの継続の可否に係る審議結果の報告について(告示番号50/ jRCTs032200423)【報告事項】 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29488.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第143回 12/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
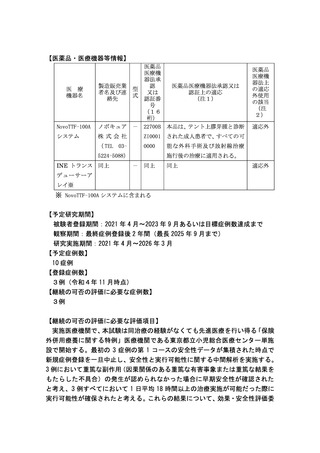
【医薬品・医療機器等情報】
NovoTTF-100A
医薬品
医療機
器法承
製造販売業
認
医薬品医療機器法承認又は
型
者名及び連
又は
認証上の適応
式
絡先
認証番
(注1)
号
(16
桁)
ノボキュア - 22700B 本品は、テント上膠芽腫と診断
システム
株式会社
ZI0001
された成人患者で、すべての可
( TEL 03-
0000
能な外科手術及び放射線治療
医 療
機器名
5224-5088)
INE トランス 同上
医薬品
医療機
器法上
の適応
外使用
の該当
(注
2)
適応外
施行後の治療に適用される。
- 同上
同上
適応外
デューサーア
レイ※
※ NovoTTF-100A システムに含まれる
【予定研究期間】
被験者登録期間:2021 年 4 月~2023 年 9 月あるいは目標症例数達成まで
観察期間:最終症例登録後 2 年間(最長 2025 年 9 月まで)
研究実施期間:2021 年 4 月~2026 年 3 月
【予定症例数】
10 症例
【登録症例数】
3例(令和4年 11 月時点)
【継続の可否の評価に必要な症例数】
3例
【継続の可否の評価に必要な評価項目】
実施医療機関で、本試験は同治療の経験がなくても先進医療を行い得る「保険
外併用療養に関する特例」医療機関である東京都立小児総合医療センター単施
設で開始する。最初の 3 症例の第 1 コースの安全性データが集積された時点で
新規症例登録を一旦中止し、安全性と実行可能性に関する中間解析を実施する。
3 例において重篤な副作用(因果関係のある重篤な有害事象または重篤な結果を
もたらした不具合)の発生が認められなかった場合に早期安全性が確認された
と考え、3 例すべてにおいて 1 日平均 18 時間以上の治療実施が可能だった際に
実行可能性が確保されたと考える。これらの結果について、効果・安全性評価委
NovoTTF-100A
医薬品
医療機
器法承
製造販売業
認
医薬品医療機器法承認又は
型
者名及び連
又は
認証上の適応
式
絡先
認証番
(注1)
号
(16
桁)
ノボキュア - 22700B 本品は、テント上膠芽腫と診断
システム
株式会社
ZI0001
された成人患者で、すべての可
( TEL 03-
0000
能な外科手術及び放射線治療
医 療
機器名
5224-5088)
INE トランス 同上
医薬品
医療機
器法上
の適応
外使用
の該当
(注
2)
適応外
施行後の治療に適用される。
- 同上
同上
適応外
デューサーア
レイ※
※ NovoTTF-100A システムに含まれる
【予定研究期間】
被験者登録期間:2021 年 4 月~2023 年 9 月あるいは目標症例数達成まで
観察期間:最終症例登録後 2 年間(最長 2025 年 9 月まで)
研究実施期間:2021 年 4 月~2026 年 3 月
【予定症例数】
10 症例
【登録症例数】
3例(令和4年 11 月時点)
【継続の可否の評価に必要な症例数】
3例
【継続の可否の評価に必要な評価項目】
実施医療機関で、本試験は同治療の経験がなくても先進医療を行い得る「保険
外併用療養に関する特例」医療機関である東京都立小児総合医療センター単施
設で開始する。最初の 3 症例の第 1 コースの安全性データが集積された時点で
新規症例登録を一旦中止し、安全性と実行可能性に関する中間解析を実施する。
3 例において重篤な副作用(因果関係のある重篤な有害事象または重篤な結果を
もたらした不具合)の発生が認められなかった場合に早期安全性が確認された
と考え、3 例すべてにおいて 1 日平均 18 時間以上の治療実施が可能だった際に
実行可能性が確保されたと考える。これらの結果について、効果・安全性評価委