よむ、つかう、まなぶ。
資料1-3-3 新型コロナワクチン接種後の死亡として報告された事例の概要(ヌバキソビッド筋注) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
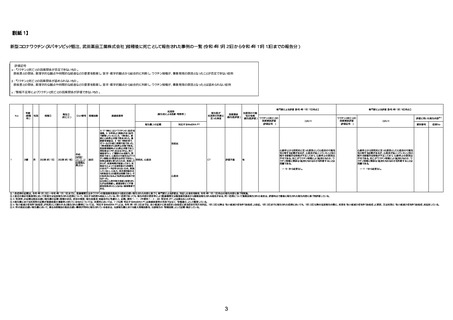
【別紙2】
新型コロナワクチン(ヌバキソビッド筋注、武田薬品工業株式会社)接種後死亡事例 死因別集計表
(令和4年5月25日から令和4年11月13日までの報告分)
(2回目接種)
※
※本頁で列挙している症状名等は、死因として確定されていないものも含め報告書に記載のあった死因と関連する可能性のある全ての症状名を計上しているものであり、当該症状等が原因で死亡したことを示すものではない。
総計
40歳未満 集計
40歳以上65歳未満 集計
65歳以上 集計
年齢不明 集計
男
女
性別不明
男
女
性別不明
男
女
性別不明
男
女
性別不明
総計
2
2
2
0
0
0
0
0
0
0
0
0
0
0
0
0
0
一般・全身障害および投与部位の状態
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
突然死
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
心臓障害
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
心筋炎
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
注1:11/13時点の報告内容に基づき集計。集計時点が別紙1(11/13)とは異なるため、追加報告の報告時期によっては、各症例の死因や年齢等について、別紙1とは異なることがある。
注2:同一症例に複数の死因等の記載がある場合はいずれも計上しているため、件数の総数と症例数は一致しない。
注3:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1−1−2や資料1−2−2の「症状名(PT)」とは異なることがある。
注4:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注5:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10
月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注6:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。「接種回数総計」は、接種回数が不明なものを含む。
5
新型コロナワクチン(ヌバキソビッド筋注、武田薬品工業株式会社)接種後死亡事例 死因別集計表
(令和4年5月25日から令和4年11月13日までの報告分)
(2回目接種)
※
※本頁で列挙している症状名等は、死因として確定されていないものも含め報告書に記載のあった死因と関連する可能性のある全ての症状名を計上しているものであり、当該症状等が原因で死亡したことを示すものではない。
総計
40歳未満 集計
40歳以上65歳未満 集計
65歳以上 集計
年齢不明 集計
男
女
性別不明
男
女
性別不明
男
女
性別不明
男
女
性別不明
総計
2
2
2
0
0
0
0
0
0
0
0
0
0
0
0
0
0
一般・全身障害および投与部位の状態
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
突然死
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
心臓障害
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
心筋炎
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
注1:11/13時点の報告内容に基づき集計。集計時点が別紙1(11/13)とは異なるため、追加報告の報告時期によっては、各症例の死因や年齢等について、別紙1とは異なることがある。
注2:同一症例に複数の死因等の記載がある場合はいずれも計上しているため、件数の総数と症例数は一致しない。
注3:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1−1−2や資料1−2−2の「症状名(PT)」とは異なることがある。
注4:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注5:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10
月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注6:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。「接種回数総計」は、接種回数が不明なものを含む。
5