よむ、つかう、まなぶ。
参考資料8 新型コロナワクチン「ヌバキソビッド筋注」(武田薬品工業株式会社)添付文書 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
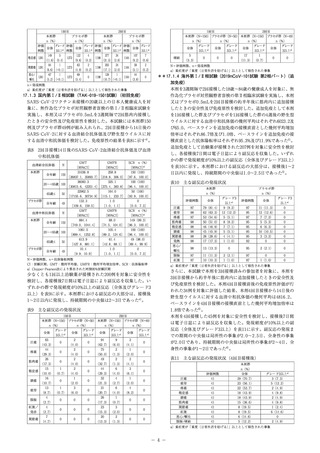
18. 薬効薬理
18.1 作用機序
本剤は、融合前のコンフォメーションで安定化し、精製された
完全長のSARS-CoV-2 rSナノ粒子で構成されている。また、
サポニンベースのMatrix-Mアジュバントの添加により、自然
免疫系の活性化を促進し、S蛋白質特異的免疫応答を高めてい
る。これら2つのワクチン成分により、S蛋白質に対するB細胞
及びT細胞の免疫応答(中和抗体を含む)が誘導されることで、
COVID-19感染症に対して防御作用を有すると考えられる。
20. 取扱い上の注意
20.1 外箱開封後は遮光して保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 現時点での知見が限られていることから、製造販売後、副反
応情報等の本剤の安全性に関するデータを、あらかじめ定めた計
画に基づき早期に収集するとともに、独立行政法人医薬品医療機
器総合機構に提出し、本剤の適正使用に必要な措置を講じること。
21.3 本剤追加接種後の免疫原性及び安全性の確認を目的として実
施中の臨床試験について、成績が得られた際には、速やかに当該
成績を独立行政法人医薬品医療機器総合機構に提出するととも
に、本剤の有効性及び安全性に係る最新の情報を、医療従事者及
び被接種者が容易に入手可能となるよう必要な措置を講じること。
21.4 本剤の接種に際し、本剤の有効性及び安全性については今後
も情報が集積されることを踏まえ、あらかじめ被接種者又は代
諾者に最新の有効性及び安全性に関する情報が文書をもって説
明され、予診票等で文書による同意を得てから接種されるよう、
医師に対して適切に説明すること。
22. 包装
バイアル
5mL:1本
23. 主要文献
1)海外第Ⅲ相試験(2022年4月19日承認、CTD2.7.6.2)
2)海外第Ⅲ相試験(社内資料)
3)海外第Ⅲ相試験(2022年4月19日承認、CTD2.7.6.3)
4)国内第Ⅰ/Ⅱ相試験(2022年4月19日承認、CTD2.7.6.1)
5)海外第Ⅰ/Ⅱ相試験(2022年4月19日承認、CTD2.7.6.4)
**6)海外第Ⅰ/Ⅱ相試験(社内資料)
24. 文献請求先及び問い合わせ先
武田薬品工業株式会社 くすり相談室
〒103-8668 東京都中央区日本橋本町二丁目1番1号
フリーダイヤル 0120-566-587
受付時間 9:00~17:30(土日祝日・弊社休業日を除く)
25. 保険給付上の注意
本剤は保険給付の対象とはならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
R6
-5-
18.1 作用機序
本剤は、融合前のコンフォメーションで安定化し、精製された
完全長のSARS-CoV-2 rSナノ粒子で構成されている。また、
サポニンベースのMatrix-Mアジュバントの添加により、自然
免疫系の活性化を促進し、S蛋白質特異的免疫応答を高めてい
る。これら2つのワクチン成分により、S蛋白質に対するB細胞
及びT細胞の免疫応答(中和抗体を含む)が誘導されることで、
COVID-19感染症に対して防御作用を有すると考えられる。
20. 取扱い上の注意
20.1 外箱開封後は遮光して保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 現時点での知見が限られていることから、製造販売後、副反
応情報等の本剤の安全性に関するデータを、あらかじめ定めた計
画に基づき早期に収集するとともに、独立行政法人医薬品医療機
器総合機構に提出し、本剤の適正使用に必要な措置を講じること。
21.3 本剤追加接種後の免疫原性及び安全性の確認を目的として実
施中の臨床試験について、成績が得られた際には、速やかに当該
成績を独立行政法人医薬品医療機器総合機構に提出するととも
に、本剤の有効性及び安全性に係る最新の情報を、医療従事者及
び被接種者が容易に入手可能となるよう必要な措置を講じること。
21.4 本剤の接種に際し、本剤の有効性及び安全性については今後
も情報が集積されることを踏まえ、あらかじめ被接種者又は代
諾者に最新の有効性及び安全性に関する情報が文書をもって説
明され、予診票等で文書による同意を得てから接種されるよう、
医師に対して適切に説明すること。
22. 包装
バイアル
5mL:1本
23. 主要文献
1)海外第Ⅲ相試験(2022年4月19日承認、CTD2.7.6.2)
2)海外第Ⅲ相試験(社内資料)
3)海外第Ⅲ相試験(2022年4月19日承認、CTD2.7.6.3)
4)国内第Ⅰ/Ⅱ相試験(2022年4月19日承認、CTD2.7.6.1)
5)海外第Ⅰ/Ⅱ相試験(2022年4月19日承認、CTD2.7.6.4)
**6)海外第Ⅰ/Ⅱ相試験(社内資料)
24. 文献請求先及び問い合わせ先
武田薬品工業株式会社 くすり相談室
〒103-8668 東京都中央区日本橋本町二丁目1番1号
フリーダイヤル 0120-566-587
受付時間 9:00~17:30(土日祝日・弊社休業日を除く)
25. 保険給付上の注意
本剤は保険給付の対象とはならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
R6
-5-