よむ、つかう、まなぶ。
資料2-1 製造販売後調査の終了に伴うリスク区分の検討について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
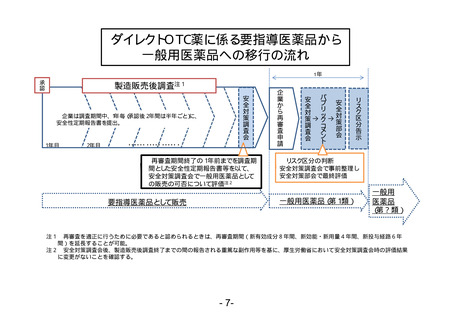
ダイレクトOTC薬に係る要指導医薬品から
一般用医薬品への移行の流れ
リスク区分告示
2年目
安全対策部会
1年目
↑
パブリックコメント
○企業は調査期間中、1年毎(承認後2年間は半年ごと)に、
安全性定期報告書を提出。
↑
安全対策調査会
安全対策調査会
製造販売後調査注1
企業から再審査申請
承認
1年
・・・・・・ ・・・・・ ・・・・・ ・
①再審査期間終了の1年前までを調査期
間とした安全性定期報告書等を以て、
安全対策調査会で一般用医薬品として
の販売の可否について評価注2
②リスク区分の判断
安全対策調査会で事前整理し
安全対策部会で最終評価
一般用医薬品(第1類)
要指導医薬品として販売
一般用
医薬品
(第?類)
注1 再審査を適正に行うために必要であると認められるときは、再審査期間(新有効成分8年間、新効能・新用量4年間、新投与経路6年
間)を延長することが可能。
注2 安全対策調査会後、製造販売後調査終了までの間の報告される重篤な副作用等を基に、厚生労働省において安全対策調査会時の評価結果
に変更がないことを確認する。
- 7-
一般用医薬品への移行の流れ
リスク区分告示
2年目
安全対策部会
1年目
↑
パブリックコメント
○企業は調査期間中、1年毎(承認後2年間は半年ごと)に、
安全性定期報告書を提出。
↑
安全対策調査会
安全対策調査会
製造販売後調査注1
企業から再審査申請
承認
1年
・・・・・・ ・・・・・ ・・・・・ ・
①再審査期間終了の1年前までを調査期
間とした安全性定期報告書等を以て、
安全対策調査会で一般用医薬品として
の販売の可否について評価注2
②リスク区分の判断
安全対策調査会で事前整理し
安全対策部会で最終評価
一般用医薬品(第1類)
要指導医薬品として販売
一般用
医薬品
(第?類)
注1 再審査を適正に行うために必要であると認められるときは、再審査期間(新有効成分8年間、新効能・新用量4年間、新投与経路6年
間)を延長することが可能。
注2 安全対策調査会後、製造販売後調査終了までの間の報告される重篤な副作用等を基に、厚生労働省において安全対策調査会時の評価結果
に変更がないことを確認する。
- 7-