よむ、つかう、まなぶ。
参考資料4-3 ゾコーバ®錠125mgに係る医薬品リスク管理計画書 (24 ページ)
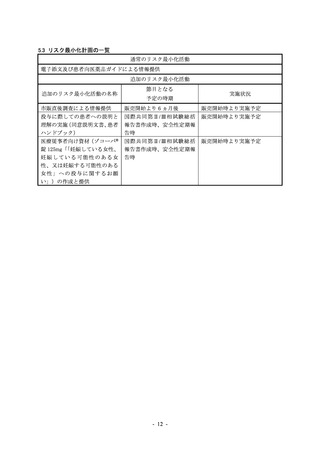
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
生殖発生毒性試験データ
●
ラット受胎能及び着床までの初期胚発生に関する試験
ラット
(各群雌雄20例)
に0(対照群)、20、60又は1000mg/kg/日のエンシトレルビル フマル酸
を1日1回反復経口投与し、雌雄の受胎能及び初期胚発生への影響を評価した。
エンシトレルビル フマル酸投与に起因する毒性変化は、雌雄共に最高用量である1000mg/kg/日
まで認められず、雌雄親動物の一般毒性、雌雄親動物の生殖機能及び初期胚発生に関する無毒性量は
1000mg/kg/日と判断した。
●
ラット胚・胎児発生に関する試験
妊娠ラット
(各群20例)
に0(対照群)、20、60又は1000mg/kg/日のエンシトレルビル フマル酸
を、胚・胎児の着床から硬口蓋閉鎖までの期間(妊娠6日目から妊娠17日目)、1日1回反復経口投与
して、妊娠20日目に帝王切開し、母動物及び胚・胎児発生への影響を評価した。
1000mg/kg/日投与群において、母動物で投与期間中に体重増加抑制及び投与初期に摂餌量減少が
認められた。胚・胎児では、1000mg/kg/日投与群で胎児発育遅延及び骨格変異所見として短小過剰
肋骨の発現頻度の増加が認められた。無毒性量は、母動物の一般毒性及び胚・胎児の発生に関し
60mg/kg/日、母動物の生殖機能に関して1000mg/kg/日と判断した。
●
ウサギ胚・胎児発生に関する試験
妊娠ウサギ(各群17〜18例)に0(対照群)、30、100又は300mg/kg/日のエンシトレルビル
フマル酸を、胚・胎児の着床から硬口蓋閉鎖までの期間(妊娠6日目から妊娠19日目)、1日1回反復
経口投与して、妊娠28日目に帝王切開し、母動物及び胚・胎児発生への影響を評価した。
100mg/kg/日以上の投与群において、母体毒性及び催奇形性が、300mg/kg/日投与群では胚・胎児
致死が認められた。認められた奇形は、軸骨格の形態異常及び関連した外表の異常(短尾)であった。
また100mg/kg/日投与群の1例では母体毒性に起因した流産が認められた。母動物の一般毒性及び
生殖機能並びに胚・胎児の発生に関する無毒性量は30mg/kg/日と判断した。
また、妊娠ウサギ
(各群18〜20例)
に0(対照群)、300mg/kg/日のエンシトレルビル フマル酸を、
1日1回、3〜4日間(妊娠6日目から妊娠9日目、妊娠10日目から妊娠12日目、妊娠13日目から妊娠
15日目)反復経口投与した際にも、300mg/kg/日投与群において、胚・胎児の致死及び同様の奇形
が認められた。
●
ラット出生前及び出生後の発生並びに母体の機能に関する試験
に0
(対照群)
、20、60又は1000mg/kg/日のエンシトレルビル フマル酸
妊娠ラット
(各群18〜20例)
を、妊娠6日から分娩を経て哺育20日まで、1日1回反復経口投与し、出生児の出生前及び出生後の
発生並びに母体の機能への影響を評価した。
1000mg/kg/日投与群において、母動物の体重の増加抑制及び低値傾向、摂餌抑制、並びに全児死亡
が認められた。出生児では、母体毒性が認められた1000mg/kg/日投与群で出生児数、生存率及び
体重の低値並びに眼瞼開裂及び雌雄の性成熟の遅延が認められた。これらを毒性変化と考え、母動物
の一般毒性及び生殖機能並びに次世代の発生に関する無毒性量は60mg/kg/日と判断した。
社内資料:エンシトレルビルの生殖発生毒性試験[承認時評価資料]
®:登録商標
禁無断転載 © 2022 SHIONOGI
XCV-C-0003(V02)審753000
2022年11月作成
●
ラット受胎能及び着床までの初期胚発生に関する試験
ラット
(各群雌雄20例)
に0(対照群)、20、60又は1000mg/kg/日のエンシトレルビル フマル酸
を1日1回反復経口投与し、雌雄の受胎能及び初期胚発生への影響を評価した。
エンシトレルビル フマル酸投与に起因する毒性変化は、雌雄共に最高用量である1000mg/kg/日
まで認められず、雌雄親動物の一般毒性、雌雄親動物の生殖機能及び初期胚発生に関する無毒性量は
1000mg/kg/日と判断した。
●
ラット胚・胎児発生に関する試験
妊娠ラット
(各群20例)
に0(対照群)、20、60又は1000mg/kg/日のエンシトレルビル フマル酸
を、胚・胎児の着床から硬口蓋閉鎖までの期間(妊娠6日目から妊娠17日目)、1日1回反復経口投与
して、妊娠20日目に帝王切開し、母動物及び胚・胎児発生への影響を評価した。
1000mg/kg/日投与群において、母動物で投与期間中に体重増加抑制及び投与初期に摂餌量減少が
認められた。胚・胎児では、1000mg/kg/日投与群で胎児発育遅延及び骨格変異所見として短小過剰
肋骨の発現頻度の増加が認められた。無毒性量は、母動物の一般毒性及び胚・胎児の発生に関し
60mg/kg/日、母動物の生殖機能に関して1000mg/kg/日と判断した。
●
ウサギ胚・胎児発生に関する試験
妊娠ウサギ(各群17〜18例)に0(対照群)、30、100又は300mg/kg/日のエンシトレルビル
フマル酸を、胚・胎児の着床から硬口蓋閉鎖までの期間(妊娠6日目から妊娠19日目)、1日1回反復
経口投与して、妊娠28日目に帝王切開し、母動物及び胚・胎児発生への影響を評価した。
100mg/kg/日以上の投与群において、母体毒性及び催奇形性が、300mg/kg/日投与群では胚・胎児
致死が認められた。認められた奇形は、軸骨格の形態異常及び関連した外表の異常(短尾)であった。
また100mg/kg/日投与群の1例では母体毒性に起因した流産が認められた。母動物の一般毒性及び
生殖機能並びに胚・胎児の発生に関する無毒性量は30mg/kg/日と判断した。
また、妊娠ウサギ
(各群18〜20例)
に0(対照群)、300mg/kg/日のエンシトレルビル フマル酸を、
1日1回、3〜4日間(妊娠6日目から妊娠9日目、妊娠10日目から妊娠12日目、妊娠13日目から妊娠
15日目)反復経口投与した際にも、300mg/kg/日投与群において、胚・胎児の致死及び同様の奇形
が認められた。
●
ラット出生前及び出生後の発生並びに母体の機能に関する試験
に0
(対照群)
、20、60又は1000mg/kg/日のエンシトレルビル フマル酸
妊娠ラット
(各群18〜20例)
を、妊娠6日から分娩を経て哺育20日まで、1日1回反復経口投与し、出生児の出生前及び出生後の
発生並びに母体の機能への影響を評価した。
1000mg/kg/日投与群において、母動物の体重の増加抑制及び低値傾向、摂餌抑制、並びに全児死亡
が認められた。出生児では、母体毒性が認められた1000mg/kg/日投与群で出生児数、生存率及び
体重の低値並びに眼瞼開裂及び雌雄の性成熟の遅延が認められた。これらを毒性変化と考え、母動物
の一般毒性及び生殖機能並びに次世代の発生に関する無毒性量は60mg/kg/日と判断した。
社内資料:エンシトレルビルの生殖発生毒性試験[承認時評価資料]
®:登録商標
禁無断転載 © 2022 SHIONOGI
XCV-C-0003(V02)審753000
2022年11月作成