よむ、つかう、まなぶ。
参考資料12 新型コロナワクチンに係る合同部会資料の構成について(令和4年10月7日合同部会資料1-9) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00059.html |
| 出典情報 | 第92回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第27回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙2
第●回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第●回薬事・食
品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
2022(令和4)年●月●日
予防接種法に基づく医療機関からの副反応疑い報告状況について
○コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
・コミナティ筋注(ファイザー)(令和3年2月17日から令和●年●月●日報告分まで)
・コミナティRTU筋注(2価:起源株/オミクロン株BA.1)(ファイザー)(令和4年9月20日から令和●年●月●日報告分まで)
・コミナティ筋注6ヵ月〜4歳用(ファイザー)(令和●年●月●日から令和●年●月●日報告分まで)
・コミナティ筋注5〜11歳用(ファイザー)(令和4年2月21日から令和●年●月●日報告分まで)
・スパイクバックス筋注(モデルナ・ジャパン)(令和3年5月22日から令和●年●月●日報告分まで)
・スパイクバックス筋注(2価:起源株/オミクロン株BA.1)(モデルナ・ジャパン)(令和4年9月20日から令和●年●月●日報告分まで)
○組換えコロナウイルス(SARS-CoV-2)ワクチン
・ヌバキソビッド筋注(武田薬品工業)(令和4年5月25日から令和●年●月●日報告分まで)
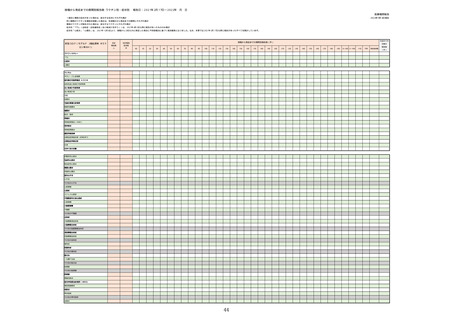
1.医療機関からの副反応疑い報告について
①
週別報告件数
②
副反応疑い報告の報告基準別報告件数
③
症状別報告件数
(ア)コミナティ筋注
(イ)コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
(ウ)コミナティ筋注6ヵ月〜4歳用
(エ)コミナティ筋注5〜11歳用
(オ)スパイクバックス筋注
(カ)スパイクバックス筋注(2価:起源株/オミクロン株BA.1)
(キ)ヌバキソビッド筋注
④
接種回数別報告件数
(ア)1回目接種者数と副反応報告件数
(イ)2回目接種者数と副反応報告件数
(ウ)3回目接種者数と副反応報告件数
(エ)4回目接種者数と副反応報告件数
⑤
ロット別報告件数
(ア)コミナティ筋注
(イ)コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
(ウ)コミナティ筋注6ヵ月〜4歳用
(エ)コミナティ筋注5〜11歳用
(オ)スパイクバックス筋注
(カ)スパイクバックス筋注(2価:起源株/オミクロン株BA.1)
(キ)ヌバキソビッド筋注
2.医療機関からの副反応疑い報告について(図表)
①
②
③
④
週別報告件数(接種日ベース)
週別報告件数(報告日ベース)
累積週別報告件数(報告日ベース)
接種から発症までの日数別報告件数
8
資料1-1-1
第●回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第●回薬事・食
品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
2022(令和4)年●月●日
予防接種法に基づく医療機関からの副反応疑い報告状況について
○コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
・コミナティ筋注(ファイザー)(令和3年2月17日から令和●年●月●日報告分まで)
・コミナティRTU筋注(2価:起源株/オミクロン株BA.1)(ファイザー)(令和4年9月20日から令和●年●月●日報告分まで)
・コミナティ筋注6ヵ月〜4歳用(ファイザー)(令和●年●月●日から令和●年●月●日報告分まで)
・コミナティ筋注5〜11歳用(ファイザー)(令和4年2月21日から令和●年●月●日報告分まで)
・スパイクバックス筋注(モデルナ・ジャパン)(令和3年5月22日から令和●年●月●日報告分まで)
・スパイクバックス筋注(2価:起源株/オミクロン株BA.1)(モデルナ・ジャパン)(令和4年9月20日から令和●年●月●日報告分まで)
○組換えコロナウイルス(SARS-CoV-2)ワクチン
・ヌバキソビッド筋注(武田薬品工業)(令和4年5月25日から令和●年●月●日報告分まで)
1.医療機関からの副反応疑い報告について
①
週別報告件数
②
副反応疑い報告の報告基準別報告件数
③
症状別報告件数
(ア)コミナティ筋注
(イ)コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
(ウ)コミナティ筋注6ヵ月〜4歳用
(エ)コミナティ筋注5〜11歳用
(オ)スパイクバックス筋注
(カ)スパイクバックス筋注(2価:起源株/オミクロン株BA.1)
(キ)ヌバキソビッド筋注
④
接種回数別報告件数
(ア)1回目接種者数と副反応報告件数
(イ)2回目接種者数と副反応報告件数
(ウ)3回目接種者数と副反応報告件数
(エ)4回目接種者数と副反応報告件数
⑤
ロット別報告件数
(ア)コミナティ筋注
(イ)コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
(ウ)コミナティ筋注6ヵ月〜4歳用
(エ)コミナティ筋注5〜11歳用
(オ)スパイクバックス筋注
(カ)スパイクバックス筋注(2価:起源株/オミクロン株BA.1)
(キ)ヌバキソビッド筋注
2.医療機関からの副反応疑い報告について(図表)
①
②
③
④
週別報告件数(接種日ベース)
週別報告件数(報告日ベース)
累積週別報告件数(報告日ベース)
接種から発症までの日数別報告件数
8
資料1-1-1