よむ、つかう、まなぶ。
別紙1 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
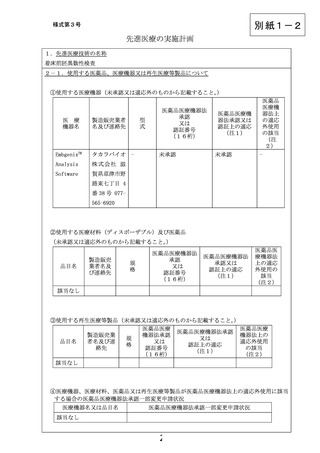
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適応外
使用に該当する場合の使用方法等
医療機関は、検体保存溶液(1%PVP/PBS)および採取用チューブを含んだ検査キット
を事前にタカラバイオ株式会社から購入し、生検した栄養外胚葉細胞を上記チューブ
に保存し、冷凍でタカラバイオ株式会社の衛生検査所へ移送する。当該衛生検査所に
て全ゲノム増幅、DNA ライブラリーの調製後、次世代シーケンサーを用いて塩基配列
を決定する。得られた塩基配列データから EmbgenixTM Analysis Software を用いて
染色体の数的異常と検出可能な染色体構造異常を検出する。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適応
の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況:未承認
欧州での薬事承認の状況:未承認
3
使用に該当する場合の使用方法等
医療機関は、検体保存溶液(1%PVP/PBS)および採取用チューブを含んだ検査キット
を事前にタカラバイオ株式会社から購入し、生検した栄養外胚葉細胞を上記チューブ
に保存し、冷凍でタカラバイオ株式会社の衛生検査所へ移送する。当該衛生検査所に
て全ゲノム増幅、DNA ライブラリーの調製後、次世代シーケンサーを用いて塩基配列
を決定する。得られた塩基配列データから EmbgenixTM Analysis Software を用いて
染色体の数的異常と検出可能な染色体構造異常を検出する。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適応
の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況:未承認
欧州での薬事承認の状況:未承認
3