よむ、つかう、まなぶ。
【資料01】先駆け審査指定制度の対象品目の指定の取消しについて[171KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33855.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和5年度第2回 6/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
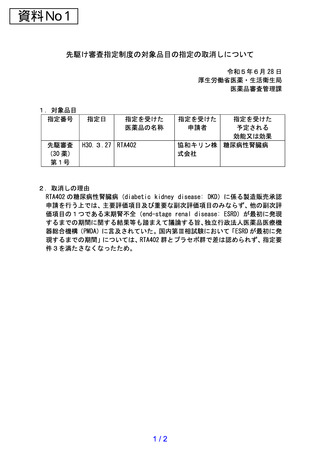
※指定の要件
(
「医薬品の先駆け審査指定制度の試行的実施(第三回)について」
(平成 29 年 10 月5日付け薬生薬審発 1005
第1号厚生労働省医薬・生活衛生局医薬品審査管理課長通知)より抜粋)
指定を受ける医薬品は、以下の4つのすべての要件を満たすこと。
(1)指定要件1:治療薬の画期性
原則として、既承認薬と異なる新作用機序であること、既承認薬と同じ作用機序であっても開発対象とす
る疾患への適応は初めてであること、又は、革新的な薬物送達システムを用いていること
(2)指定要件2:対象疾患の重篤性
以下のいずれかの疾患に該当するものであること
・
生命に重大な影響がある重篤な疾患
・
根治療法がなく症状(社会生活が困難な状態)が継続している疾患
(3)指定要件3:対象疾患に係る極めて高い有効性
既承認薬が存在しない、若しくは既存の治療薬/治療法に比べて有効性の大幅な改善が見込まれる、又は
著しい安全性の向上が見込まれること
(4)指定要件4:世界に先駆けて日本で早期開発・申請する意思・体制
日本における早期開発を重視し、世界に先駆けて日本で承認申請される(同時申請も含む)予定のもので
あり、承認申請できる体制を有していること。なお、国内での開発が着実に進んでいることが確認できる以
下の両方に該当する治療薬であることが望ましい。
・
First In Human (FIH) 試験が日本で行われたもの
・
Proof Of Concept (POC) 試験が日本で行われたもの
また、使用に当たってコンパニオン診断薬等が必要となる医薬品を申請する場合は、当該診断薬等も並行
して承認申請できる体制(他社との連携体制を含む。
)を有していること。
2/2
(
「医薬品の先駆け審査指定制度の試行的実施(第三回)について」
(平成 29 年 10 月5日付け薬生薬審発 1005
第1号厚生労働省医薬・生活衛生局医薬品審査管理課長通知)より抜粋)
指定を受ける医薬品は、以下の4つのすべての要件を満たすこと。
(1)指定要件1:治療薬の画期性
原則として、既承認薬と異なる新作用機序であること、既承認薬と同じ作用機序であっても開発対象とす
る疾患への適応は初めてであること、又は、革新的な薬物送達システムを用いていること
(2)指定要件2:対象疾患の重篤性
以下のいずれかの疾患に該当するものであること
・
生命に重大な影響がある重篤な疾患
・
根治療法がなく症状(社会生活が困難な状態)が継続している疾患
(3)指定要件3:対象疾患に係る極めて高い有効性
既承認薬が存在しない、若しくは既存の治療薬/治療法に比べて有効性の大幅な改善が見込まれる、又は
著しい安全性の向上が見込まれること
(4)指定要件4:世界に先駆けて日本で早期開発・申請する意思・体制
日本における早期開発を重視し、世界に先駆けて日本で承認申請される(同時申請も含む)予定のもので
あり、承認申請できる体制を有していること。なお、国内での開発が着実に進んでいることが確認できる以
下の両方に該当する治療薬であることが望ましい。
・
First In Human (FIH) 試験が日本で行われたもの
・
Proof Of Concept (POC) 試験が日本で行われたもの
また、使用に当たってコンパニオン診断薬等が必要となる医薬品を申請する場合は、当該診断薬等も並行
して承認申請できる体制(他社との連携体制を含む。
)を有していること。
2/2