よむ、つかう、まなぶ。
【資料3】(補足資料)小児用医薬品の開発促進に資する薬事審査等のあり方について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34601.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第2回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
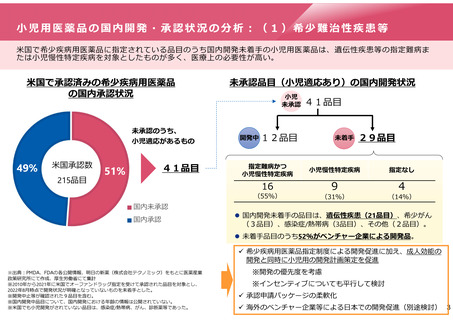
小児用医薬品の国内開発・承認状況の分析:(2)抗悪性腫瘍薬
米国で小児適応をもつ抗悪性腫瘍薬について、 6割が国内では小児適応未承認。ただし、そのうち三分の二は成人効
能は承認済み。
米国で小児適応をもつ抗悪性腫瘍薬の国内開発の状況
小児未承認の内訳
小児効能
承認済
小児効能
未承認
米国
40
-
-
-
日本
16
24
16
8
成人承認済 成人も含め
(小児適応外) 未承認
国内開発企業の内訳
製薬大手
11品目
製薬大手以外
5品目
※ 必ずしも成人と小児において適応症が同一とは限らない。分子標的
薬の場合、成人と小児でがんの種類が異なっていても、その分子標
的または作用機序に共通性があれば対象となり得る
(国内開発中)※成人・小児の区
5品目
成人と小児の
同時開発が必要
(開発未着手)
別は不明
※米国ではすべて
オーファンかつ優
先審査対象
3品目
国内開発企業の内訳
製薬大手
2品目
製薬大手以外
3品目
成人効能の開発をする品目については、同時に小児用の開発計画策定を促進
※開発の優先度を考慮
※インセンティブについても平行して検討
国内開発
促進が必要
※米国ではすべてオーファン、
うち1品目が優先審査対象
3品目全てが製薬大手以
外による開発品
海外のベンチャー企業等による
日本での開発促進(別途検討)
承認申請パッケージの柔軟化
※出典:PMDA、FDAの各公開情報、ClinicalTrials.govをもとに医薬産業政策研究所にて作成、厚生労働省にて集計
※2000年から2022年に米国で小児適応を受けて承認された品目を対象とし、2023年3月時点で開発状況が明確となっていないものを未着手とした。
※製薬大手とは小児適応取得時にグループ連結売上高が 50億米ドル以上の企業を指す。
※国内開発企業と海外開発企業は必ずしも同一ではない
※米国の優先審査対象:Treat a serious
condition and if approved, would provide a
significant improvement in safety or
effectiveness over available therapies
米国で小児適応をもつ抗悪性腫瘍薬について、 6割が国内では小児適応未承認。ただし、そのうち三分の二は成人効
能は承認済み。
米国で小児適応をもつ抗悪性腫瘍薬の国内開発の状況
小児未承認の内訳
小児効能
承認済
小児効能
未承認
米国
40
-
-
-
日本
16
24
16
8
成人承認済 成人も含め
(小児適応外) 未承認
国内開発企業の内訳
製薬大手
11品目
製薬大手以外
5品目
※ 必ずしも成人と小児において適応症が同一とは限らない。分子標的
薬の場合、成人と小児でがんの種類が異なっていても、その分子標
的または作用機序に共通性があれば対象となり得る
(国内開発中)※成人・小児の区
5品目
成人と小児の
同時開発が必要
(開発未着手)
別は不明
※米国ではすべて
オーファンかつ優
先審査対象
3品目
国内開発企業の内訳
製薬大手
2品目
製薬大手以外
3品目
成人効能の開発をする品目については、同時に小児用の開発計画策定を促進
※開発の優先度を考慮
※インセンティブについても平行して検討
国内開発
促進が必要
※米国ではすべてオーファン、
うち1品目が優先審査対象
3品目全てが製薬大手以
外による開発品
海外のベンチャー企業等による
日本での開発促進(別途検討)
承認申請パッケージの柔軟化
※出典:PMDA、FDAの各公開情報、ClinicalTrials.govをもとに医薬産業政策研究所にて作成、厚生労働省にて集計
※2000年から2022年に米国で小児適応を受けて承認された品目を対象とし、2023年3月時点で開発状況が明確となっていないものを未着手とした。
※製薬大手とは小児適応取得時にグループ連結売上高が 50億米ドル以上の企業を指す。
※国内開発企業と海外開発企業は必ずしも同一ではない
※米国の優先審査対象:Treat a serious
condition and if approved, would provide a
significant improvement in safety or
effectiveness over available therapies