よむ、つかう、まなぶ。
○費用対効果評価の結果を踏まえた薬価の見直しについて 総-4参考3 (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00202.html |
| 出典情報 | 中央社会保険医療協議会 総会(第552回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
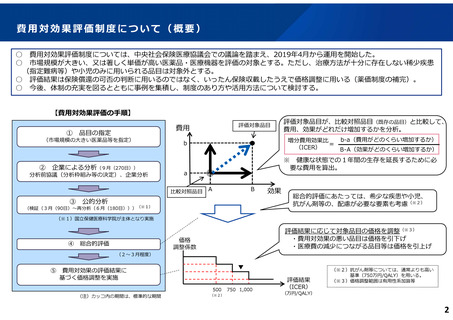
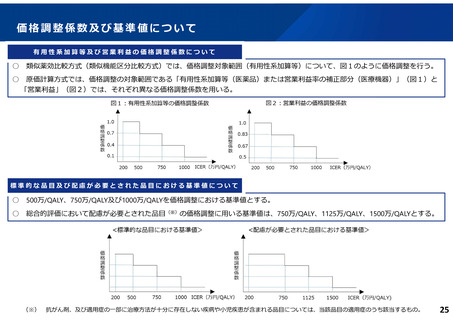
費用対効果評価の結果及び価格調整係数について
ICERの区分
別に定める条件
基本区分
総合的評価で配慮が必要とされたもの
ドミナント
(比較対照技術に対し効果が増加し、かつ費
用が削減されるものをいう。)
(同左)
比較対照技術に対し効果が同等であり、かつ
費用が削減されるもの
(同左)
200 万円/QALY 未満
(同左)
200 万円/QALY 以上500 万円/QALY 未満
価格調整係数※3
β
γ
θ
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.25
1.25
1.0
それ以外のもの
1.0
1.0
1.0
200 万円/QALY 以上750 万円/QALY 未満
1.0
1.0
1.0
500 万円/QALY 以上750 万円/QALY 未満
750 万円/QALY 以上1,125 万円/QALY 未満
0.7
0.7
0.83
750 万円/QALY 以上1,000 万円/QALY 未満
1,125 万円/QALY 以上1,500 万円/QALY 未満
0.4
0.4
0.67
1,000 万円/QALY 以上
1,500 万円/QALY 以上
0.1
0.1
0.5
比較対象技術に対し効果が同等であり、かつ
費用が増加するもの
(同左)
0.1
0.1
0.5
※1
※2
※1
(一)対象品目の効果が比較対照技術に対し増加又は同等であることが、メタ解析及びシステマチックレビューを除く臨床試験により示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※2
(一)対象品目に係るメタ解析及びシステマチックレビューを除く臨床研究が、次のいずれにも該当すること。
( ア) 対象品目に係る新規の臨床研究に関する論文が、impactfactor(Clarivate analytics 社の“InCites Journal CitationReports”により提供されているimpact factor を
いう。)の平均値(当該論文の受理又は論文掲載時から過去5年間の平均値)が15.0 を超える学術誌に原著論文として受理されていること。
(イ)当該論文を受理した学術誌が、レビュー雑誌又は創刊10 年以内の学術誌でないこと。
(ウ)当該臨床研究において、比較対照技術より効果が増加することが日本人を含むアジア人を対象とした集団において統計学的に示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※3
(1)類似薬効比較方式等により算定された医薬品
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1-β)
(2)原価計算方式により算定された医薬品(開示率が低いものに限る。)
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1- γ)- 営業利益部分 × (1-θ)
(3)別途、価格引下げの下限、価格引上げの上限のルールあり。
(4)価格調整に当たって、分析期間を超過した場合には、事前に企業に対して遅れた理由を確認した上で、その理由が妥当性を欠く場合については、最も小さな価格調整係数を用いることとする。
29
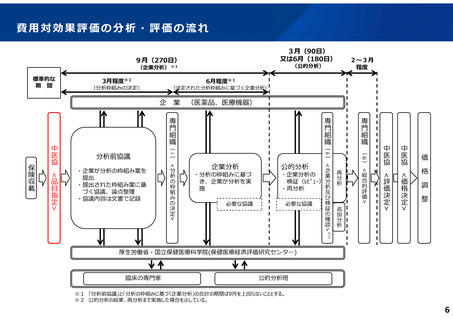
ICERの区分
別に定める条件
基本区分
総合的評価で配慮が必要とされたもの
ドミナント
(比較対照技術に対し効果が増加し、かつ費
用が削減されるものをいう。)
(同左)
比較対照技術に対し効果が同等であり、かつ
費用が削減されるもの
(同左)
200 万円/QALY 未満
(同左)
200 万円/QALY 以上500 万円/QALY 未満
価格調整係数※3
β
γ
θ
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.25
1.25
1.0
それ以外のもの
1.0
1.0
1.0
200 万円/QALY 以上750 万円/QALY 未満
1.0
1.0
1.0
500 万円/QALY 以上750 万円/QALY 未満
750 万円/QALY 以上1,125 万円/QALY 未満
0.7
0.7
0.83
750 万円/QALY 以上1,000 万円/QALY 未満
1,125 万円/QALY 以上1,500 万円/QALY 未満
0.4
0.4
0.67
1,000 万円/QALY 以上
1,500 万円/QALY 以上
0.1
0.1
0.5
比較対象技術に対し効果が同等であり、かつ
費用が増加するもの
(同左)
0.1
0.1
0.5
※1
※2
※1
(一)対象品目の効果が比較対照技術に対し増加又は同等であることが、メタ解析及びシステマチックレビューを除く臨床試験により示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※2
(一)対象品目に係るメタ解析及びシステマチックレビューを除く臨床研究が、次のいずれにも該当すること。
( ア) 対象品目に係る新規の臨床研究に関する論文が、impactfactor(Clarivate analytics 社の“InCites Journal CitationReports”により提供されているimpact factor を
いう。)の平均値(当該論文の受理又は論文掲載時から過去5年間の平均値)が15.0 を超える学術誌に原著論文として受理されていること。
(イ)当該論文を受理した学術誌が、レビュー雑誌又は創刊10 年以内の学術誌でないこと。
(ウ)当該臨床研究において、比較対照技術より効果が増加することが日本人を含むアジア人を対象とした集団において統計学的に示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※3
(1)類似薬効比較方式等により算定された医薬品
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1-β)
(2)原価計算方式により算定された医薬品(開示率が低いものに限る。)
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1- γ)- 営業利益部分 × (1-θ)
(3)別途、価格引下げの下限、価格引上げの上限のルールあり。
(4)価格調整に当たって、分析期間を超過した場合には、事前に企業に対して遅れた理由を確認した上で、その理由が妥当性を欠く場合については、最も小さな価格調整係数を用いることとする。
29