よむ、つかう、まなぶ。
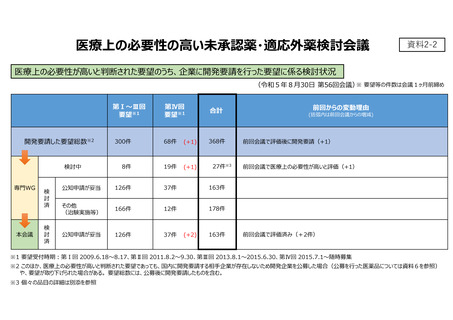
資料2-2 開発要請を行った要望に係る検討状況について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00030.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第56回 8/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
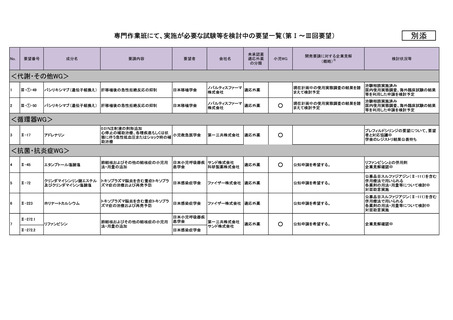
No.
要望番号
成分名
要請内容
要望者
会社名
日本神経内分泌腫
瘍研究会
MSD株式会社
日本膵臓学会
パンキャンジャパン
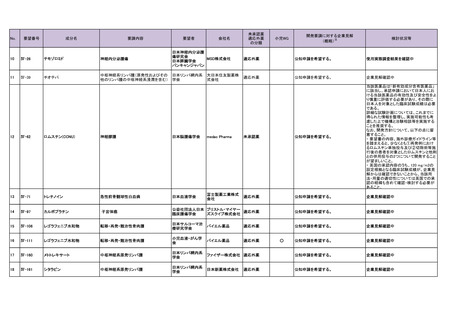
10
Ⅳ-26
テモゾロミド
神経内分泌腫瘍
11
Ⅳ-39
チオテパ
中枢神経系リンパ腫(原発性およびその 日本リンパ網内系
他のリンパ腫の中枢神経系浸潤を含む) 学会
大日本住友製薬株
式会社
未承認薬
適応外薬
の分類
小児WG
開発要請に対する企業見解
注
(概略)
検討状況等
適応外薬
公知申請を希望する。
使用実態調査結果を確認中
適応外薬
公知申請を希望する。
企業見解確認中
12
Ⅳ-62
ロムスチン(CCNU)
神経膠腫
日本脳腫瘍学会
medac Pharma
未承認薬
公知申請を希望する。
当該医薬品は「新有効成分含有医薬品」
に該当し、承認申請において日本人にお
ける当該医薬品の有効性及び安全性をよ
り慎重に評価する必要があり、その際に
日本人を対象とした臨床試験成績は必要
である。
詳細な試験計画については、これまでに
得られた情報を整理し、実施可能性も考
慮した上で機構と治験相談等を実施する
ことを推奨する。
なお、開発方針について、以下の点に留
意すること。
要望書の内容、海外診療ガイドライン等
を踏まえると、少なくとも①再発例におけ
るロムスチン単独投与及び②切除術等施
行後の患者を対象としたロムスチンと他剤
との併用投与の2つについて開発すること
が望ましいこと。
英国の承認内容のうち、120 mg/m2の
設定根拠となる臨床試験成績が、企業見
解からは確認できないことから、当該用
法・用量の適切性については英国での承
認の経緯も含めて確認・検討する必要が
あること。
13
Ⅳ-71
トレチノイン
急性前骨髄球性白血病
日本血液学会
富士製薬工業株式
会社
適応外薬
公知申請を希望する。
企業見解確認中
14
Ⅳ-97
カルボプラチン
子宮体癌
公益社団法人日本 ブリストル・マイヤー
適応外薬
臨床腫瘍学会
ズスクイブ株式会社
公知申請を希望する。
企業見解確認中
15
Ⅳ-106
レゴラフェニブ水和物
転移・再発・難治性骨肉腫
日本サルコーマ治
療研究学会
バイエル薬品
適応外薬
公知申請を希望する。
企業見解確認中
16
Ⅳ-111
レゴラフェニブ水和物
転移・再発・難治性骨肉腫
小児血液・がん学
会
バイエル薬品
適応外薬
公知申請を希望する。
企業見解確認中
17
Ⅳ-160
メトトレキサート
中枢神経系原発リンパ腫
日本リンパ網内系
学会
ファイザー株式会社 適応外薬
公知申請を希望する。
企業見解確認中
18
Ⅳ-161
シタラビン
中枢神経系原発リンパ腫
日本リンパ網内系
学会
日本新薬株式会社
公知申請を希望する。
企業見解確認中
適応外薬
○
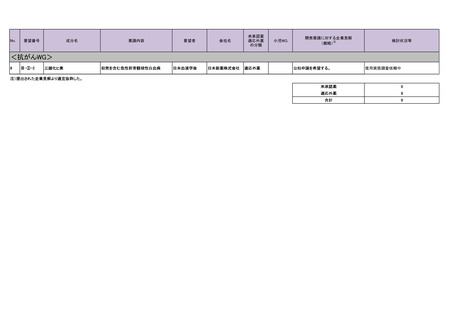
要望番号
成分名
要請内容
要望者
会社名
日本神経内分泌腫
瘍研究会
MSD株式会社
日本膵臓学会
パンキャンジャパン
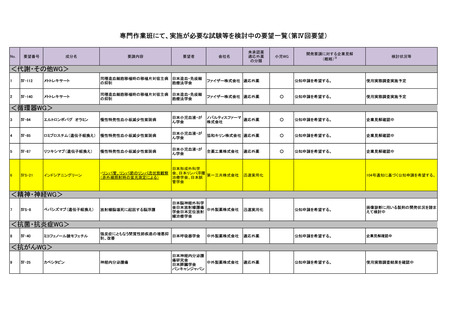
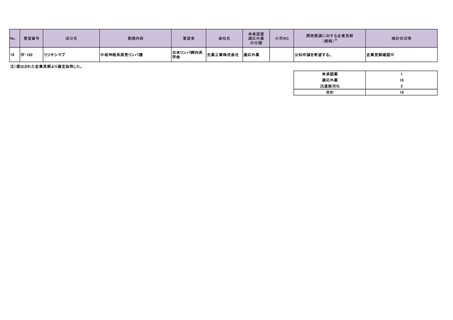
10
Ⅳ-26
テモゾロミド
神経内分泌腫瘍
11
Ⅳ-39
チオテパ
中枢神経系リンパ腫(原発性およびその 日本リンパ網内系
他のリンパ腫の中枢神経系浸潤を含む) 学会
大日本住友製薬株
式会社
未承認薬
適応外薬
の分類
小児WG
開発要請に対する企業見解
注
(概略)
検討状況等
適応外薬
公知申請を希望する。
使用実態調査結果を確認中
適応外薬
公知申請を希望する。
企業見解確認中
12
Ⅳ-62
ロムスチン(CCNU)
神経膠腫
日本脳腫瘍学会
medac Pharma
未承認薬
公知申請を希望する。
当該医薬品は「新有効成分含有医薬品」
に該当し、承認申請において日本人にお
ける当該医薬品の有効性及び安全性をよ
り慎重に評価する必要があり、その際に
日本人を対象とした臨床試験成績は必要
である。
詳細な試験計画については、これまでに
得られた情報を整理し、実施可能性も考
慮した上で機構と治験相談等を実施する
ことを推奨する。
なお、開発方針について、以下の点に留
意すること。
要望書の内容、海外診療ガイドライン等
を踏まえると、少なくとも①再発例におけ
るロムスチン単独投与及び②切除術等施
行後の患者を対象としたロムスチンと他剤
との併用投与の2つについて開発すること
が望ましいこと。
英国の承認内容のうち、120 mg/m2の
設定根拠となる臨床試験成績が、企業見
解からは確認できないことから、当該用
法・用量の適切性については英国での承
認の経緯も含めて確認・検討する必要が
あること。
13
Ⅳ-71
トレチノイン
急性前骨髄球性白血病
日本血液学会
富士製薬工業株式
会社
適応外薬
公知申請を希望する。
企業見解確認中
14
Ⅳ-97
カルボプラチン
子宮体癌
公益社団法人日本 ブリストル・マイヤー
適応外薬
臨床腫瘍学会
ズスクイブ株式会社
公知申請を希望する。
企業見解確認中
15
Ⅳ-106
レゴラフェニブ水和物
転移・再発・難治性骨肉腫
日本サルコーマ治
療研究学会
バイエル薬品
適応外薬
公知申請を希望する。
企業見解確認中
16
Ⅳ-111
レゴラフェニブ水和物
転移・再発・難治性骨肉腫
小児血液・がん学
会
バイエル薬品
適応外薬
公知申請を希望する。
企業見解確認中
17
Ⅳ-160
メトトレキサート
中枢神経系原発リンパ腫
日本リンパ網内系
学会
ファイザー株式会社 適応外薬
公知申請を希望する。
企業見解確認中
18
Ⅳ-161
シタラビン
中枢神経系原発リンパ腫
日本リンパ網内系
学会
日本新薬株式会社
公知申請を希望する。
企業見解確認中
適応外薬
○