よむ、つかう、まなぶ。
資料1 予防接種データベースについて (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00063.html |
| 出典情報 | 第95回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和5年度第7回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)() |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
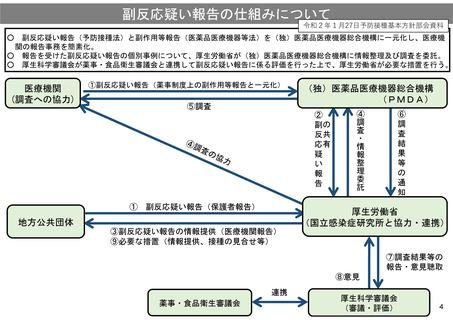
副反応疑い報告の仕組みについて
令和2年1月27日予防接種基本方針部会資料
○
副反応疑い報告(予防接種法)と副作用等報告(医薬品医療機器等法)を(独)医薬品医療機器総合機構に一元化し、医療機
関の報告事務を簡素化。
○ 報告を受けた副反応疑い報告の個別事例について、厚生労働省が(独)医薬品医療機器総合機構に情報整理及び調査を委託。
○ 厚生科学審議会が薬事・食品衛生審議会と連携して副反応疑い報告に係る評価を行った上で、厚生労働省が必要な措置を行う。
医療機関
(調査への協力)
①副反応疑い報告(薬事制度上の副作用等報告と一元化)
⑤調査
(独)医薬品医療機器総合機構
(PMDA)
②
副の
反共
応有
疑
い
報
告
①
副反応疑い報告(保護者報告)
地方公共団体
③副反応疑い報告の情報提供(医療機関報告)
⑨必要な措置(情報提供、接種の見合せ等)
④
調
査
・
情
報
整
理
委
託
⑥
調
査
結
果
等
の
通
知
厚生労働省
(国立感染症研究所と協力・連携)
⑦調査結果等の
報告・意見聴取
⑧意見
連携
薬事・食品衛生審議会
厚生科学審議会
(審議・評価)
4
令和2年1月27日予防接種基本方針部会資料
○
副反応疑い報告(予防接種法)と副作用等報告(医薬品医療機器等法)を(独)医薬品医療機器総合機構に一元化し、医療機
関の報告事務を簡素化。
○ 報告を受けた副反応疑い報告の個別事例について、厚生労働省が(独)医薬品医療機器総合機構に情報整理及び調査を委託。
○ 厚生科学審議会が薬事・食品衛生審議会と連携して副反応疑い報告に係る評価を行った上で、厚生労働省が必要な措置を行う。
医療機関
(調査への協力)
①副反応疑い報告(薬事制度上の副作用等報告と一元化)
⑤調査
(独)医薬品医療機器総合機構
(PMDA)
②
副の
反共
応有
疑
い
報
告
①
副反応疑い報告(保護者報告)
地方公共団体
③副反応疑い報告の情報提供(医療機関報告)
⑨必要な措置(情報提供、接種の見合せ等)
④
調
査
・
情
報
整
理
委
託
⑥
調
査
結
果
等
の
通
知
厚生労働省
(国立感染症研究所と協力・連携)
⑦調査結果等の
報告・意見聴取
⑧意見
連携
薬事・食品衛生審議会
厚生科学審議会
(審議・評価)
4