よむ、つかう、まなぶ。
参考資料2 <現行>副反応疑い報告書 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00063.html |
| 出典情報 | 第95回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和5年度第7回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)() |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
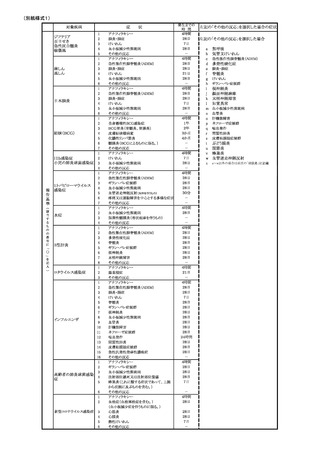
(別紙様式1)
注意事項>
1
2.
9.
4
5.
6.
12.
13.
14.
15.
16.
17.
報告に当たっては、 記入要領を参考に、記入してください。
必要に応じて、適宜、 予診票等、接種時の状況の分かるものを添付してください。
報告書中の「症状名」には、原則として医学的に認められている症状名を記載してください。
4 記載された症状が未回復である場合には「未回復」の欄に、 記載された症状による障害等がある場合には「後遺症」の欄に
記載してください。
報告基準にある算用数字を付している症状については、「その他の反応」を除き、それぞれ定められている時間までに発症した場合は、
因果関係の有無を間わず、国に報告することが予防接種法等で義務付けられています。
報告基準中の「その他の反応」については、①入院、②死亡又は永続的な機能不全に陥る又は陥るおそれがある場合でめって、それが
予防接種を受けたことによるものと疑われる症状について、報告してください。 なお、 アルファベットで示した症状で該当するものがある場
合には、〇で囲んでください。
報告基準中の発生までの時間を超えて発生した場合であっても、それが予防接種を受けたことによるものと疑われる症状については、
「その他の反応」として報告してください。 その際には、アルファベットで例示した症状で該当するものがある場合には、〇で囲んでくださ
い。
報告基準は、予防接種後に一定の期間内に現れた症状を報告するためのものであり、 予防接種との因果関係や予防接種健康被害救
済と直接に結びつくものではありません。
記入欄が不足する場合には、別紙に記載し、 報告書に添付してください。
報告された情報については、厚生労働省、 国立感染症研究所、独立行政法人医薬品医療機器総合機構で共有します。 また、 愚者(被
接種者)氏名、生年月日を除いた情報を、 製造販売業者に提供します。 報告を行った医療機関等に対し、 医楽品医療機器総合機構又は
製造販売業者が詳細調査を行う場合があります。
報告された情報については、ワクチンの安全対策の一環として、 広く情報を公表することがありますが、その場合には、施設名及び患者
のプライバシー等に関する部分は除きます。
患者に予防接種を行った医師等以外の医師等も予防接種を受けたことによるものと疑われる症状を知った場合には報告を行う2ものとされ
ています。 なお、 報告いただく場合においては、把所が困難な事項については、 記載いただかなくて結構です。
ヒトパピローマウイルス感染症の予防接種に関する注意事項は以下のとおりです。
・広範な慢性の商痛又は運動障害を中心とする多様な症状を呈する愚者を診察した際には、ヒトパピローマウイルス感染症の定期の予防
接種又は任意接種を受けたかどうかを確認してください。
・ヒ上トパピローマウイルス成染症の定期接種にあっては、接種後に広範な慢性の導痛又は運動障害を中心とする多様な症状が発生する場
合があるため、これらの症状と接種との関連性を認めた場合、 報告してください。
・ヒトパピローマウイルス感染症の任意接種にあっては、接種後に広範な慢性の商痛又は運動障害を中心とする多様な症状が発生した場
合、医薬品、 医療機可等の品質、有効性及び安全性の確保等に関する法律第68条の10第2項の規定に基づき、 薬局開設者、病院若しく
は診療所の開設者又は医師、歯科医師、薬剤師その他の医薬関係者は、 速やかに報告してください。
・ヒトパピローマウイルス成梁症のキャッチアップ接種にあっては、 過去に接種したヒトパピローマウイルス様粒子ワクチンの種類が不明の場
合、結果として、 異なる種類のワクチンが接種される可能性があるため、ワクチンの互換性に関する安全性、 免疫原性及び有効性について
の情報収集の観点から、 予診票での留意点にその財明記してください。
独立行政法人医薬品医療機緒総合機構ウェブサイト上にて報告に係る記入要領を示しているため、 報告にあたっては参照してくださ
い。
新型コロナワクチンについては、これまでワクチン接種との因果関係が示されていない症状も含め、幅広く評価を行っていく必要があるこ
とから、 当面の間、以下の症状については規定による副反応医い報告を積極的に検討するとともに、これら以外の症状についても必要に
応じて報告を検討してください。
けいれん (ただし、 熱性けいれんを除く。 ) 、ギラン・バレ症候群、 急性散在性脳春髄(ADEM) 、 血小板減少性紫斑病、 血管衝、 無菌性
髄膜炎、脳炎・脳症、 春髄炎、 関節炎、顔面神経麻痺、 血管迷走神経反射(失神を伴2もの)
また、「血栓症(血栓塞栓症を含む。 ) (i小板減少症を伴2ものに限る。 )」、心筋衝又は心膜炎について報告する場合には、別紙様式1
記入要領別表の記載も踏まえ、別紙様式1に加えて、 血栓症(血栓塞栓症を含む。 ) (血小板減少症を伴うものに限る。 ) (TTS) 調査票、
心筋炎調査票又は心膜炎調査票をそれぞれ作成し、 報告してください。ただし、心筋炎及び心膜炎がともに疑われる場合には、心筋炎
調査票及び心膜炎調査票の両方を作成して報告してください。
なお、 独立行政法人医薬品医療機器総合機構ウェブサイト上にて新型コロナワクチンに係る報告の記載例を示しているため、 報告にあ
たっては参照してください。
電子報告システム(報告受付サイト) による報告は、以下の独立行政法人医薬品医療機器総合機構ウェブサイトよりアクセスし、 報告を作
成、提出してください。
URL : https://www.pmda.go.jp/safety/reports/hcp/0002.html
FAXでの報告は、独立行政法人医薬品医療機器総合機構の下記宛に送付してください。 その際、 報告基準に係る表についても、 併せ
て送付してください。
新型コロナワクチン専用FAX番号:0120-011-126
その他のワクチン用FAX番号:0120-176-146
注意事項>
1
2.
9.
4
5.
6.
12.
13.
14.
15.
16.
17.
報告に当たっては、 記入要領を参考に、記入してください。
必要に応じて、適宜、 予診票等、接種時の状況の分かるものを添付してください。
報告書中の「症状名」には、原則として医学的に認められている症状名を記載してください。
4 記載された症状が未回復である場合には「未回復」の欄に、 記載された症状による障害等がある場合には「後遺症」の欄に
記載してください。
報告基準にある算用数字を付している症状については、「その他の反応」を除き、それぞれ定められている時間までに発症した場合は、
因果関係の有無を間わず、国に報告することが予防接種法等で義務付けられています。
報告基準中の「その他の反応」については、①入院、②死亡又は永続的な機能不全に陥る又は陥るおそれがある場合でめって、それが
予防接種を受けたことによるものと疑われる症状について、報告してください。 なお、 アルファベットで示した症状で該当するものがある場
合には、〇で囲んでください。
報告基準中の発生までの時間を超えて発生した場合であっても、それが予防接種を受けたことによるものと疑われる症状については、
「その他の反応」として報告してください。 その際には、アルファベットで例示した症状で該当するものがある場合には、〇で囲んでくださ
い。
報告基準は、予防接種後に一定の期間内に現れた症状を報告するためのものであり、 予防接種との因果関係や予防接種健康被害救
済と直接に結びつくものではありません。
記入欄が不足する場合には、別紙に記載し、 報告書に添付してください。
報告された情報については、厚生労働省、 国立感染症研究所、独立行政法人医薬品医療機器総合機構で共有します。 また、 愚者(被
接種者)氏名、生年月日を除いた情報を、 製造販売業者に提供します。 報告を行った医療機関等に対し、 医楽品医療機器総合機構又は
製造販売業者が詳細調査を行う場合があります。
報告された情報については、ワクチンの安全対策の一環として、 広く情報を公表することがありますが、その場合には、施設名及び患者
のプライバシー等に関する部分は除きます。
患者に予防接種を行った医師等以外の医師等も予防接種を受けたことによるものと疑われる症状を知った場合には報告を行う2ものとされ
ています。 なお、 報告いただく場合においては、把所が困難な事項については、 記載いただかなくて結構です。
ヒトパピローマウイルス感染症の予防接種に関する注意事項は以下のとおりです。
・広範な慢性の商痛又は運動障害を中心とする多様な症状を呈する愚者を診察した際には、ヒトパピローマウイルス感染症の定期の予防
接種又は任意接種を受けたかどうかを確認してください。
・ヒ上トパピローマウイルス成染症の定期接種にあっては、接種後に広範な慢性の導痛又は運動障害を中心とする多様な症状が発生する場
合があるため、これらの症状と接種との関連性を認めた場合、 報告してください。
・ヒトパピローマウイルス感染症の任意接種にあっては、接種後に広範な慢性の商痛又は運動障害を中心とする多様な症状が発生した場
合、医薬品、 医療機可等の品質、有効性及び安全性の確保等に関する法律第68条の10第2項の規定に基づき、 薬局開設者、病院若しく
は診療所の開設者又は医師、歯科医師、薬剤師その他の医薬関係者は、 速やかに報告してください。
・ヒトパピローマウイルス成梁症のキャッチアップ接種にあっては、 過去に接種したヒトパピローマウイルス様粒子ワクチンの種類が不明の場
合、結果として、 異なる種類のワクチンが接種される可能性があるため、ワクチンの互換性に関する安全性、 免疫原性及び有効性について
の情報収集の観点から、 予診票での留意点にその財明記してください。
独立行政法人医薬品医療機緒総合機構ウェブサイト上にて報告に係る記入要領を示しているため、 報告にあたっては参照してくださ
い。
新型コロナワクチンについては、これまでワクチン接種との因果関係が示されていない症状も含め、幅広く評価を行っていく必要があるこ
とから、 当面の間、以下の症状については規定による副反応医い報告を積極的に検討するとともに、これら以外の症状についても必要に
応じて報告を検討してください。
けいれん (ただし、 熱性けいれんを除く。 ) 、ギラン・バレ症候群、 急性散在性脳春髄(ADEM) 、 血小板減少性紫斑病、 血管衝、 無菌性
髄膜炎、脳炎・脳症、 春髄炎、 関節炎、顔面神経麻痺、 血管迷走神経反射(失神を伴2もの)
また、「血栓症(血栓塞栓症を含む。 ) (i小板減少症を伴2ものに限る。 )」、心筋衝又は心膜炎について報告する場合には、別紙様式1
記入要領別表の記載も踏まえ、別紙様式1に加えて、 血栓症(血栓塞栓症を含む。 ) (血小板減少症を伴うものに限る。 ) (TTS) 調査票、
心筋炎調査票又は心膜炎調査票をそれぞれ作成し、 報告してください。ただし、心筋炎及び心膜炎がともに疑われる場合には、心筋炎
調査票及び心膜炎調査票の両方を作成して報告してください。
なお、 独立行政法人医薬品医療機器総合機構ウェブサイト上にて新型コロナワクチンに係る報告の記載例を示しているため、 報告にあ
たっては参照してください。
電子報告システム(報告受付サイト) による報告は、以下の独立行政法人医薬品医療機器総合機構ウェブサイトよりアクセスし、 報告を作
成、提出してください。
URL : https://www.pmda.go.jp/safety/reports/hcp/0002.html
FAXでの報告は、独立行政法人医薬品医療機器総合機構の下記宛に送付してください。 その際、 報告基準に係る表についても、 併せ
て送付してください。
新型コロナワクチン専用FAX番号:0120-011-126
その他のワクチン用FAX番号:0120-176-146