よむ、つかう、まなぶ。
資料6 先進医療Bの試験実施計画の変更について(告示番号54/ jRCTs051210055) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36522.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第156回 12/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療Bの試験実施計画の変更について
【申請医療機関】
国立研究開発法人 国立循環器病研究センター
【先進医療告示番号と名称】
大臣告示番号 B54
テネクテプラーゼ静脈内投与療法
【適応症】
脳梗塞(発症から四・五時間以内のものに限る。
)
【試験の概要】
脳梗塞急性期に対して、血栓溶解薬テネクテプラーゼの有効性と安全性を確立する。具体
的には、発症後 4.5 時間以内の脳主幹動脈閉塞による脳梗塞急性期患者におけるテネクテ
プラーゼの安全性(症候性頭蓋内出血の有無及び凝固線溶系マーカー)を少数例で確認(安
全性検討フェーズ)する。その後、有効性(脳主幹動脈閉塞の再開通効果)及び安全性をア
ルテプラーゼを対照として非マスキング無作為化並行群間比較試験にて検討し、試験薬開
始後早期の良好な血管再開通に関するテネクテプラーゼのアルテプラーゼに対する優越性
を証明する(比較検証フェーズ)。
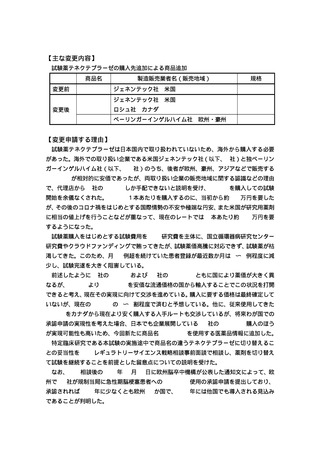
【医薬品・医療機器情報】
一般名
テネクテプラーゼ
商品名
製造販売業者名
規格
TNKase® ジェネンテック社
50mg
医薬品医療機器法上の
適応外使用の該当
未承認
【実施期間】
研究予定期間: 2021年9月1日〜2027年3月31日
(登録期間: 2021 年 9 月 1 日〜2026 年 9 月 30 日)
【予定症例数】
226 症例
【現在の登録状況】
126 症例(うち比較検証フェーズとして 122 症例)2023 年 11 月 30 日現在)
【申請医療機関】
国立研究開発法人 国立循環器病研究センター
【先進医療告示番号と名称】
大臣告示番号 B54
テネクテプラーゼ静脈内投与療法
【適応症】
脳梗塞(発症から四・五時間以内のものに限る。
)
【試験の概要】
脳梗塞急性期に対して、血栓溶解薬テネクテプラーゼの有効性と安全性を確立する。具体
的には、発症後 4.5 時間以内の脳主幹動脈閉塞による脳梗塞急性期患者におけるテネクテ
プラーゼの安全性(症候性頭蓋内出血の有無及び凝固線溶系マーカー)を少数例で確認(安
全性検討フェーズ)する。その後、有効性(脳主幹動脈閉塞の再開通効果)及び安全性をア
ルテプラーゼを対照として非マスキング無作為化並行群間比較試験にて検討し、試験薬開
始後早期の良好な血管再開通に関するテネクテプラーゼのアルテプラーゼに対する優越性
を証明する(比較検証フェーズ)。
【医薬品・医療機器情報】
一般名
テネクテプラーゼ
商品名
製造販売業者名
規格
TNKase® ジェネンテック社
50mg
医薬品医療機器法上の
適応外使用の該当
未承認
【実施期間】
研究予定期間: 2021年9月1日〜2027年3月31日
(登録期間: 2021 年 9 月 1 日〜2026 年 9 月 30 日)
【予定症例数】
226 症例
【現在の登録状況】
126 症例(うち比較検証フェーズとして 122 症例)2023 年 11 月 30 日現在)