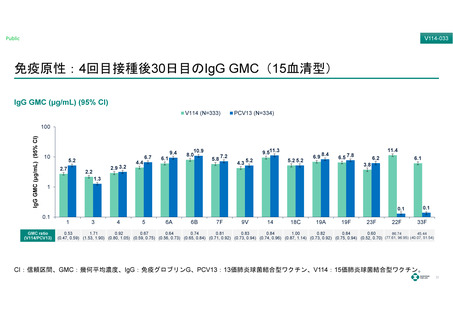
よむ、つかう、まなぶ。
10参考資料1-5_MSD株式会社提出資料(第21回ワクチン評価に関する小委員会 資料1-2) (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36952.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第58回 12/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
V114-027
Public
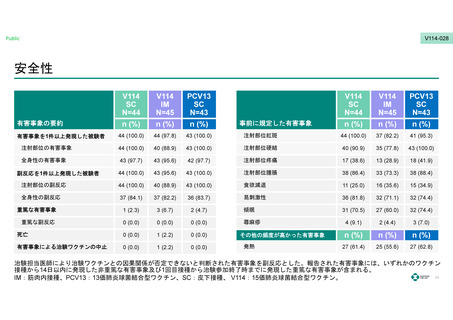
安全性
第1群
事前に規定した注射部位の有害事象*1
第2群
第3群
第4群
第5群
(N = 179)
n / N (%)
(N = 181)
n / N (%)
(N = 178)
n / N (%)
(N = 179)
n / N (%)
(N = 179)
n / N (%)
128 (71.5)
114 (63.0)
123 (69.1)
121 (67.6)
127 (70.9)
第1群
第2群
事前に規定した全身性の有害事象*2
139 (77.7)
136 (75.1)
137 (77.0)
147 (82.1)
143 (79.9)
第3群
第4群
有害事象
168 (93.9)
165 (91.2)
165 (92.7)
167 (93.3)
163 (91.1)
第5群
PCV13
重篤な副反応
0 (0)
0 (0)
1 (0.6)
0 (0)
V114
0 (0)
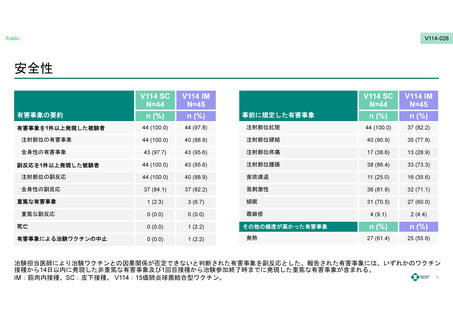
各接種後14日目までの事前に規定した注射部位の有害事象及び全身性の有害事象、すべての有害事象、試験終了までの重篤な副反応。
*1 発赤/紅斑、硬結、圧痛/疼痛、腫脹のいずれかが1件以上発現した数。
*2 食欲減退、易刺激性、傾眠/傾眠状態、蕁麻疹/膨疹のいずれかが1件以上発現した数。
25
Public
安全性
第1群
事前に規定した注射部位の有害事象*1
第2群
第3群
第4群
第5群
(N = 179)
n / N (%)
(N = 181)
n / N (%)
(N = 178)
n / N (%)
(N = 179)
n / N (%)
(N = 179)
n / N (%)
128 (71.5)
114 (63.0)
123 (69.1)
121 (67.6)
127 (70.9)
第1群
第2群
事前に規定した全身性の有害事象*2
139 (77.7)
136 (75.1)
137 (77.0)
147 (82.1)
143 (79.9)
第3群
第4群
有害事象
168 (93.9)
165 (91.2)
165 (92.7)
167 (93.3)
163 (91.1)
第5群
PCV13
重篤な副反応
0 (0)
0 (0)
1 (0.6)
0 (0)
V114
0 (0)
各接種後14日目までの事前に規定した注射部位の有害事象及び全身性の有害事象、すべての有害事象、試験終了までの重篤な副反応。
*1 発赤/紅斑、硬結、圧痛/疼痛、腫脹のいずれかが1件以上発現した数。
*2 食欲減退、易刺激性、傾眠/傾眠状態、蕁麻疹/膨疹のいずれかが1件以上発現した数。
25