よむ、つかう、まなぶ。
資料3-1~2 モメタゾンフランカルボン酸エステル水和物 (5 ページ)
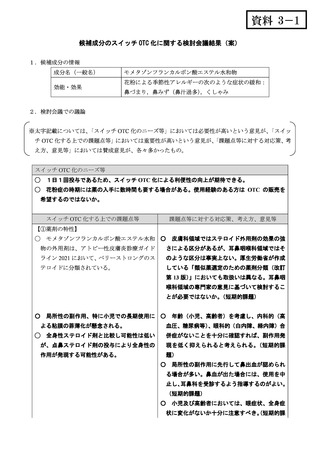
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198111_00025.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第27回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
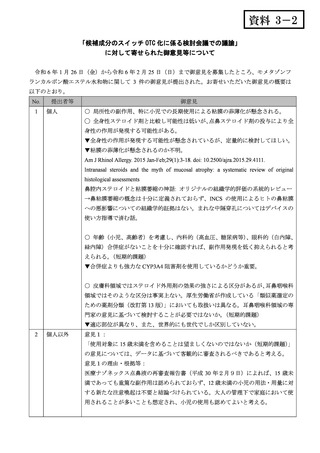
意見2:
「1年間に3ヵ月を超えて使用しないこととするのが妥当で、小児ではさらに短い
方が良い。(短期的課題)
」の意見については、データに基づいて客観的に審査され
るべきであると考える。
意見2の理由・根拠等:
本剤が季節性アレルギー性鼻炎専用で症状の緩和を目的として使用される場面を考
慮すると、小児に限って使用期間を短くすることは、適切ではないと考える。
以下のデータに基づき、小児適用では医療用医薬品の注意事項に含まれる「可能性
は低いが全身性の作用が発現する可能性がある」旨の注意喚起は必要と考えるが、
OTC 医薬品の要望効能である季節性アレルギー性鼻炎の症状緩和を目的とした使
用方法においては、長期間、大量投与することは想定していないことと併せて、成
人と比べて特段の使用期間の制限を付ける必要性を示す根拠は認められていないと
考えられた。
鼻アレルギー診療ガイドライン(2023 年版)では1年以上の連用でも全身的副作用
は少なく、局所的副作用として軽度の鼻内刺激感、乾燥感、鼻しゃく熱感、鼻出血
などがときに見られる、と評価されていることと、既承認のステロイド点鼻薬がス
イッチ OTC 承認後3年間の PMS 終了後に安全性が評価されて、指定第2類医薬品
にリスクダウンされている実績に鑑み、使用期間の上限はデータに基づき審査され
るべきである。
小児の適用についても同様に、医療用ナゾネックス点鼻液の再審査報告書(平成 30
年2月9日)による、15 歳未満の承認であっても重篤な副作用は認められておらず、
12 歳未満の小児の用法・用量に対する新たな注意喚起は不要と結論づけられている
データを根拠に審査されるべきである。
<公表情報を踏まえた追加意見>
再審査報告書によると、特定使用成績調査(長期使用に関する調査、観察期間 24 週
間、2,880 例の安全性解析対象集団)で重篤な副作用は認められなかった。このうち、
小児(15 歳未満)の安全性解析症例 76 例では、1例(上咽頭炎1件)の副作用で
あった。
同じく、特定使用成績調査(16 歳未満の小児アレルギー性鼻炎患者に関する調査、
観察期間 24 週間以上、338 例の安全性解析対象集団)でも、重篤な副作用は認めら
れず、新たな注意喚起等は不要と考えられた。
またインタビューフォームでは「小児第3相長期投与試験3歳以上 15 歳以下の通
年性アレルギー性鼻炎(小児)を対象とした長期投与試験において、1 日 1 回、朝
に 12 週間投与した時の副作用は 6.3%(5/80 例)に認められた。最も発現率が高
かった副作用は「鼻出血」3.8%(3/80 例)であった。次いで、
「適用部位刺激感」
、
「気管支炎」、
「鼻乾燥」でいずれも 1.3%(1/80 例)であった。いずれの副作用も
程度は軽度又は中等度で重度の事象はなく、臨床上特に問題となる事象はなかっ
た。」とされている。
3
個人
現在の日本において季節性アレルギー性鼻炎の罹患率は高く、まさに国民病とも
17 / 30
「1年間に3ヵ月を超えて使用しないこととするのが妥当で、小児ではさらに短い
方が良い。(短期的課題)
」の意見については、データに基づいて客観的に審査され
るべきであると考える。
意見2の理由・根拠等:
本剤が季節性アレルギー性鼻炎専用で症状の緩和を目的として使用される場面を考
慮すると、小児に限って使用期間を短くすることは、適切ではないと考える。
以下のデータに基づき、小児適用では医療用医薬品の注意事項に含まれる「可能性
は低いが全身性の作用が発現する可能性がある」旨の注意喚起は必要と考えるが、
OTC 医薬品の要望効能である季節性アレルギー性鼻炎の症状緩和を目的とした使
用方法においては、長期間、大量投与することは想定していないことと併せて、成
人と比べて特段の使用期間の制限を付ける必要性を示す根拠は認められていないと
考えられた。
鼻アレルギー診療ガイドライン(2023 年版)では1年以上の連用でも全身的副作用
は少なく、局所的副作用として軽度の鼻内刺激感、乾燥感、鼻しゃく熱感、鼻出血
などがときに見られる、と評価されていることと、既承認のステロイド点鼻薬がス
イッチ OTC 承認後3年間の PMS 終了後に安全性が評価されて、指定第2類医薬品
にリスクダウンされている実績に鑑み、使用期間の上限はデータに基づき審査され
るべきである。
小児の適用についても同様に、医療用ナゾネックス点鼻液の再審査報告書(平成 30
年2月9日)による、15 歳未満の承認であっても重篤な副作用は認められておらず、
12 歳未満の小児の用法・用量に対する新たな注意喚起は不要と結論づけられている
データを根拠に審査されるべきである。
<公表情報を踏まえた追加意見>
再審査報告書によると、特定使用成績調査(長期使用に関する調査、観察期間 24 週
間、2,880 例の安全性解析対象集団)で重篤な副作用は認められなかった。このうち、
小児(15 歳未満)の安全性解析症例 76 例では、1例(上咽頭炎1件)の副作用で
あった。
同じく、特定使用成績調査(16 歳未満の小児アレルギー性鼻炎患者に関する調査、
観察期間 24 週間以上、338 例の安全性解析対象集団)でも、重篤な副作用は認めら
れず、新たな注意喚起等は不要と考えられた。
またインタビューフォームでは「小児第3相長期投与試験3歳以上 15 歳以下の通
年性アレルギー性鼻炎(小児)を対象とした長期投与試験において、1 日 1 回、朝
に 12 週間投与した時の副作用は 6.3%(5/80 例)に認められた。最も発現率が高
かった副作用は「鼻出血」3.8%(3/80 例)であった。次いで、
「適用部位刺激感」
、
「気管支炎」、
「鼻乾燥」でいずれも 1.3%(1/80 例)であった。いずれの副作用も
程度は軽度又は中等度で重度の事象はなく、臨床上特に問題となる事象はなかっ
た。」とされている。
3
個人
現在の日本において季節性アレルギー性鼻炎の罹患率は高く、まさに国民病とも
17 / 30