よむ、つかう、まなぶ。
創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39934.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書の公表について(4/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
日本
米国
条件付き承認制度
Accelerated Approval
⚫ 希少疾病用医薬品、先駆的
医薬品など医療上特にその
必要性が高く*、検証的臨床
試験の実施が困難又は相当
適用条件
の時間を要する
* 重篤な疾患を対象とし、既
存の治療法がない又はそれ
と比較して有効性又は安全
EU
Conditional Marketing
Authorization
⚫ 重篤又は生命を脅かす疾患を
⚫ 重篤又は生命を脅かす疾患
を対象とする
対象とする(パンデミック等
の緊急な状況も含む)
⚫ 適切な代替エンドポイント
⚫ データが不完全ではあるもの
において、既存治療を上回
のベネフィットがリスクを上
る有益な治療効果が示され
回る(当該医薬品を迅速に提
る
供することによる国民の健康
への利益が大きい)
性が優れる
⚫ 臨床効果を証明する試験の
⚫ 使用成績に関する調査、適
正使用確保のために必要な
市販後
措置等の実施
⚫ ベネフィットがリスクを上回
⚫ 市販後臨床試験の実施状況
を定期的に FDA に報告
⚫ 承認時に指定された期間内
に調査成績等を提出し、中
間評価を実施
実施
⚫ Labeling に迅速承認された
医薬品である旨を記載
⚫ 迅速な承認取り下げ手続き
ることを確認する試験の実施
⚫ 条件付き承認の有効期間は 1
年(更新は可能)
⚫ 添付文書に条件付き承認であ
る旨を記載
の規定あり
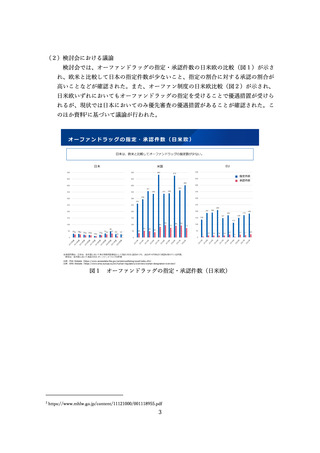
表1 日米欧の迅速な承認制度
しかしながら、日本の条件付き承認制度は、米国の Accelerated Approval(迅速承認)
や EU の Conditional Approval と比べて、適用件数が少ないことから、製薬業界やベ
ンチャー企業、患者団体等から、その運用の拡大を求める声がある。
欧米の運用状況を調査研究した令和5年度厚生労働科学特別研究事業(研究代表
者:北里大学成川衛教授)の中間報告も踏まえ、我が国における迅速な承認制度のあ
り方について検討した。
(2)検討会における議論
<検証的試験における日本人データの必要性の整理について>
検討会での議論は、2回に分けて行われた。
1回目の議論は、事務局作成の資料 9 に基づいて行われた。また、日本製薬工業協
会・柏谷構成員から資料10が提出された。
製薬業界からは、次のような意見が示された。
9
https://www.mhlw.go.jp/content/11121000/001177937.pdf
10
https://www.mhlw.go.jp/content/11121000/001177938.pdf
18
米国
条件付き承認制度
Accelerated Approval
⚫ 希少疾病用医薬品、先駆的
医薬品など医療上特にその
必要性が高く*、検証的臨床
試験の実施が困難又は相当
適用条件
の時間を要する
* 重篤な疾患を対象とし、既
存の治療法がない又はそれ
と比較して有効性又は安全
EU
Conditional Marketing
Authorization
⚫ 重篤又は生命を脅かす疾患を
⚫ 重篤又は生命を脅かす疾患
を対象とする
対象とする(パンデミック等
の緊急な状況も含む)
⚫ 適切な代替エンドポイント
⚫ データが不完全ではあるもの
において、既存治療を上回
のベネフィットがリスクを上
る有益な治療効果が示され
回る(当該医薬品を迅速に提
る
供することによる国民の健康
への利益が大きい)
性が優れる
⚫ 臨床効果を証明する試験の
⚫ 使用成績に関する調査、適
正使用確保のために必要な
市販後
措置等の実施
⚫ ベネフィットがリスクを上回
⚫ 市販後臨床試験の実施状況
を定期的に FDA に報告
⚫ 承認時に指定された期間内
に調査成績等を提出し、中
間評価を実施
実施
⚫ Labeling に迅速承認された
医薬品である旨を記載
⚫ 迅速な承認取り下げ手続き
ることを確認する試験の実施
⚫ 条件付き承認の有効期間は 1
年(更新は可能)
⚫ 添付文書に条件付き承認であ
る旨を記載
の規定あり
表1 日米欧の迅速な承認制度
しかしながら、日本の条件付き承認制度は、米国の Accelerated Approval(迅速承認)
や EU の Conditional Approval と比べて、適用件数が少ないことから、製薬業界やベ
ンチャー企業、患者団体等から、その運用の拡大を求める声がある。
欧米の運用状況を調査研究した令和5年度厚生労働科学特別研究事業(研究代表
者:北里大学成川衛教授)の中間報告も踏まえ、我が国における迅速な承認制度のあ
り方について検討した。
(2)検討会における議論
<検証的試験における日本人データの必要性の整理について>
検討会での議論は、2回に分けて行われた。
1回目の議論は、事務局作成の資料 9 に基づいて行われた。また、日本製薬工業協
会・柏谷構成員から資料10が提出された。
製薬業界からは、次のような意見が示された。
9
https://www.mhlw.go.jp/content/11121000/001177937.pdf
10
https://www.mhlw.go.jp/content/11121000/001177938.pdf
18